题目内容
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下:
(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H= -1455.0kJ·mol-1、△H=" -285.8" kJ·mol-1。写出以CO2、H2合成CH3OCH3的热化学方程式: ;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。写出吸收CO2反应的化学方程式 ;
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL· min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为 ;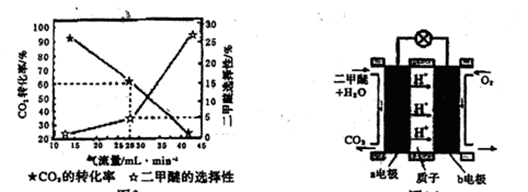
图1 图2
(4)图2为二甲醚燃料电池示意图。
①a电极的电极反应式为 ;
②若以1.12 L·min-l(标准状况)的速率向该电池中通入二甲醚,用该电池电解50mL2 mol·L-1 CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
(1)
(2)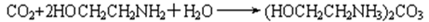
(3)20mol
(4)① CH3OCH3-12e-+3H2O=2CO2+12H+
② 6.4g (每空2分)
解析试题分析:(1)已知:CH30CH3(g)、H2(g)的标准燃烧热分别为:△H=-1455.OkJ?mol-1、△H=-285.8kJ?mol-1,①CH30CH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1455.0kJ?mol-1;
②H2(g)+1/2O2(g)═H2O(l)△H=-285.8kJ?mol-1,依据盖斯定律②×6-①得到:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ?mol?1,写出以CO2、H2合成CH3OCH3的热化学方程式为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H=-259.8kJ?mol?1。
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作C02吸收剂,乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,结合二氧化碳生成碳酸盐,反应的化学方程式为:2HOCH2CH2NH2+H2O+CO2?(HOCH2CH2NH3)2CO3。
(3)生产0.3mol二甲醚,理论上应生成二甲醚物质的量0.3mol÷5%=6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为12mol÷60%=20mol。
(4)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+。
②若以1.12L?min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol?L-1 CuS04溶液,通电0.50min后,通入二甲醚物质的量=1.12L/min×0.50min÷22.4L/mol
=0.025mol;依据电极反应电子守恒,CH3OCH3~12e-,n(e?)=0.025mol×12=0.3mol, 50mL2 mol·L-1 CuSO4溶液,Cu2+共0.05mol×2mol?L?1=0.1mol,Cu2+完全反应,所以m(Cu)=0.1mol×64g/mol=6.4g
考点:本题考查热化学方程式的书写、电极方程式的书写及相关计算。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案我国工业上主要采用以下四种方法降低尾气中的含硫量:
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
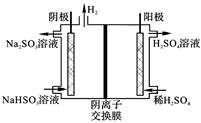
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
(1)方法1中已知:① CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____;此反应的平衡常数表达式为:_____。
(2)方法2中最后产品中含有少量(NH4)2SO3,为测定(NH4)2SO4的含量,分析员设计以下步骤:
①准确称取13.9 g 样品,溶解;
②向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸;
③加入足量的氯化钡溶液,过滤;
④进行两步实验操作;
⑤称量,得到固体23.3 g,计算。
步骤②的目的是:_____。步骤④两步实验操作的名称分别为: _____、_____。样品中(NH4)2SO4的质量分数:____(保留两位有效数字)。
(3)据研究表明方法3的气配比最适宜为0.75[即煤气(CO、H2的体积分数之和为90%)∶SO2烟气(SO2体积分数不超过15%)流量=30∶40]。用平衡原理解释保持气配比为0.75的目的是:_____。
(4)方法4中用惰性电极电解溶液的装置如图所示。阳极电极反应方程式为_____。
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
| A.热裂解形成燃油 | B.露天焚烧 | C.作为有机复合建筑材料的原料 | D.直接填埋 |
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1

在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率(×10-3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
(5) 已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ;
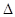 H
H
用△H1、△H2和△H3表示
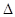 H,
H,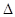 H= 。
H= 。(6)已知1 g FeS2(s)完全燃烧生成放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。
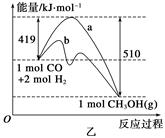
 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。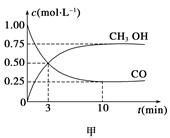
 增大的有____________。
增大的有____________。 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 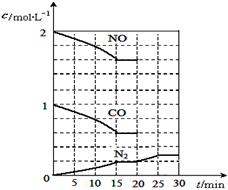
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。