题目内容
【题目】常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入到20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( )
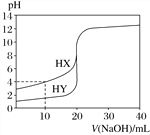
A. V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-)
B. V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C. V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-)
D. pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-)
【答案】B
【解析】A.由图可知V(NaOH)=20.00mL时,两者恰好完全反应,HX的PH大于HY,所以NaX的水解程度大于NaY,则两份溶液中,c(X-)<c(Y-),故A错误;B.V(NaOH)=10.00mL时,生成等物质的量浓度的HX和NaX,溶液呈酸性,以HX的电离为主,所以离子浓度的大小为:,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故B正确;C.由图可知V(NaOH)=20.00mL时,两者恰好完全反应,都生成强碱弱酸盐,水解呈碱性,所以离子浓度的大小为:c(Na+)>c(X-)>c(OH-)>c(H+),故C错误;D.NaX的水解程度大于NaY,而pH=7时,两份溶液中第一份需氢氧化钠的物质的量少,根据电荷守恒,c(X-)>c(Y-),故D错误;故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



