题目内容
【题目】2009年我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。
(1)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是___。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(2)BeCl2熔点较低,易升华,其化学性质与AlCl3相似,可推测BeCl2熔融态___(选填“导电”或“不导电”),请写出BeCl2水解的化学方程式___。
(3)铝及其化合物在日常生活、工业上有广泛的应用。国产C919飞机外壳应用了铝合金材料。下列铝合金的性质与其用于飞机外壳无关的是(_______)
a.密度小 b.能导电 c.抗腐蚀性能强 d.硬度大
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是___。
a.Al2O3、MgO和SiO2都不溶于水 b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 d.Al2O3、MgO和SiO2都有很高的熔点
(5)明矾可作净水剂。明矾(KAl(SO4)2·12H2O)的水溶液呈___性(选填“酸”、“碱”或“中”),写出明矾在水溶液中的电离反应方程式___;溶液中离子浓度大小顺序为___。
(6)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因___(用方程式说明);写出Al(OH)3的电离方程式___。
【答案】bc 不导电 BeCl2+2H2O![]() Be(OH)2+2HCl b d 酸 KAl(SO4)2 = K++Al3++2SO42- c(SO42)>c(K+)>c(Al3+)>c(H+)>c(OH) 2Al(OH)3
Be(OH)2+2HCl b d 酸 KAl(SO4)2 = K++Al3++2SO42- c(SO42)>c(K+)>c(Al3+)>c(H+)>c(OH) 2Al(OH)3![]() Al2O3+3H2O,氢氧化铝分解吸热,生成的氧化铝覆盖在可燃物表面,起到阻燃作用 Al3++3OH
Al2O3+3H2O,氢氧化铝分解吸热,生成的氧化铝覆盖在可燃物表面,起到阻燃作用 Al3++3OH![]() Al(OH)3
Al(OH)3![]() H++AlO2+H2O
H++AlO2+H2O
【解析】
(1)a选项,不能用单质的硬度和熔点来衡量金属性强弱,故a错误;
b选项,在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液,溶解的说明氢氧化物碱性弱,即Al的金属性弱,故b正确;
c选项,将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,Mg片在热水中反应,Al片在热水中不反应,即Mg得活泼性强,故c正确;
d选项,将空气中放置已久的这两种元素的单质,表面生成了氧化膜,氧化膜都不与热水反应,故d错误;
综上所述,答案为bc;
(2)BeCl2熔点较低,易升华,说明BeCl2是共价化合物,在熔融状态不导电,BeCl2水解生成氢氧化铍和盐酸,其化学方程式为BeCl2+2H2O![]() Be(OH)2+2HCl;
Be(OH)2+2HCl;
(3)国产C919飞机外壳应用了铝合金材料,主要是因密度小,康腐蚀性能强,硬度大的特点,与能导电无关,故答案为:b;
(4)Al2O3、MgO和SiO2都可以制耐火材料,主要是因为其熔点高,故答案为:d;
(5)明矾(KAl(SO4)2·12H2O)的水溶液是由于铝离子发生水解,溶液呈酸性,明矾在水溶液中的电离反应方程式KAl(SO4)2 = K++Al3++2SO42-,溶液中离子浓度大小顺序为c(SO42)>c(K+)>c(Al3+)>c(H+)>c(OH);
(6)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,氢氧化铝能做阻燃剂的原因是因为2Al(OH)3![]() Al2O3+3H2O,氢氧化铝分解吸热,生成的氧化铝覆盖在可燃物表面,起到阻燃作用,Al(OH)3的电离可酸式电离也可碱式电离,其电离方程式为:Al3++3OH
Al2O3+3H2O,氢氧化铝分解吸热,生成的氧化铝覆盖在可燃物表面,起到阻燃作用,Al(OH)3的电离可酸式电离也可碱式电离,其电离方程式为:Al3++3OH![]() Al(OH)3
Al(OH)3![]() H++AlO2+H2O。
H++AlO2+H2O。

【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是_________(填序号).
A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶
于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?_____________________________________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向
滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为____________________________________________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向
滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为____________________________________________。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为_______________________________________。
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10-2;Ka2=6.2×10-8 |
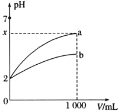
(1) 25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,三种溶液的pH由大到小的顺序为 _______________
(2)工业上可用氨水除去尾气SO2。将SO2通入氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的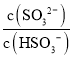 =___________
=___________
(3)常温下,用0.1000mol/L溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图:
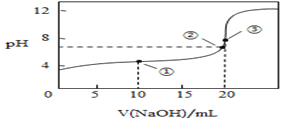
①在滴定的实验过程中,不需要的仪器或用品是________(填序号)
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
②到达滴定终点的标志是:___________________________
③下列操作会导致测定结果偏高的是 _________________
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
④如图点①所示溶液中c(CH3COO-)+c(OH-)__________c(CH3COOH)+c(H+)(填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
”,下同);点②所示溶液(pH=7)c(Na+)________ c(CH3COO-)+c(CH3COOH);点③所示溶液中所有离子浓度由大到小的顺序为:_______________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______/span>mol/L,此时溶液中c(CrO42-)等于_________mol/L(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。