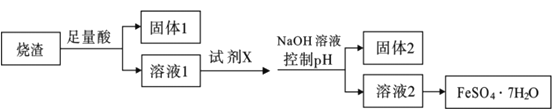
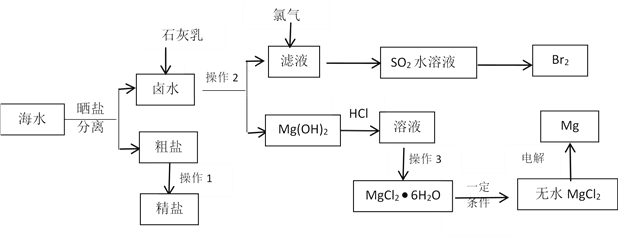
题目内容
【题目】常温下,![]() 是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的
是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的![]() 溶液中,溶液中
溶液中,溶液中![]() ,
,![]() ,
,![]() 的物质的量分数
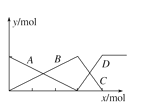
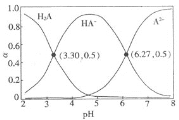
的物质的量分数![]() 随溶液pH的变化关系如图所示。下列说法错误的是
随溶液pH的变化关系如图所示。下列说法错误的是![]()
![]()
A.常温下,![]()
![]() 的电离平衡常数
的电离平衡常数![]()
B.当![]() 时,溶液呈中性
时,溶液呈中性
C.![]() 时,
时,![]()
D.![]() 溶液
溶液![]() :
:![]() 溶液
溶液![]() 时,
时,![]()
【答案】D
【解析】
A.图象中c(H2A)=c(HA-),结合平衡常数K=c(H+)计算;
B.溶液中存在电荷守恒分析判断;
C.pH=6.27,c(A2-)=c(HA-),溶液显酸性;
D.等物质的量浓度时,V(NaOH溶液):V(H2A溶液)=3:2,则溶液中存在物料守恒2c(Na+)=3c(A2-)+3c(HA-)+3c(H2A);
A.由图象知,pH=3.30时c(H2A)=c(HA-),常温下,H2A![]() HA-+H+的电离平衡常数
HA-+H+的电离平衡常数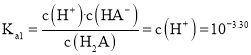 ,A正确;
,A正确;
B.溶液中存在电荷守恒:![]() ,当c(Na+)=2c(A2-)+c(HA-)时,c(H+)=c(OH-),溶液呈中性,B正确;
,当c(Na+)=2c(A2-)+c(HA-)时,c(H+)=c(OH-),溶液呈中性,B正确;
C.![]() ,
,![]() ,溶液显酸性,溶液中离子浓度关系为:
,溶液显酸性,溶液中离子浓度关系为:![]() ,C正确;
,C正确;
D.等物质的量浓度时,V(NaOH溶液):V(H2A溶液)=3:2,则溶液中存在物料守恒,2c(Na+)=3c(A2-)+3c(HA-)+3c(H2A),电荷守恒:![]() ,计算得到
,计算得到![]() ,D错误;
,D错误;
故合理选项是D。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目