题目内容
“原子经济”这一术语是由斯坦福大学Barry Trost教授提出来的,这是一个关于有多少反应物转变成最终产物的概念。最理想的经济当然是全部反应物的原子嵌入期望的最终产物中,不产生任何废弃物,这时的原子经济便是100%。下列反应中原子经济百分数有可能达到100%的反应是( )
| A.取代反应 | B.加成反应 | C.酯化反应 | D.水解反应 |
B
本题考查学生的信息处理能力;根据题中信息,原子经济百分数达到100%的反应即反应物原子全部转化为欲得产物,而无任何废弃物,取代反应、酯化反应、水解反应的产物有两种,不符合在“原子经济”的要求,而加成反应中只有一种产物,符合“原子经济”的要求。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
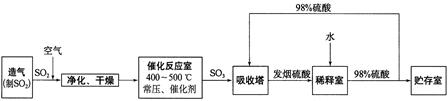
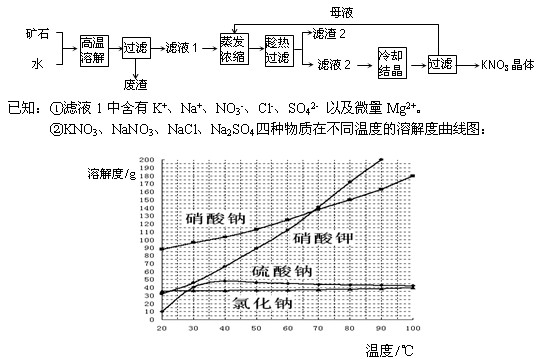
 是一种重要的化工原料,工业上生产硝酸的主要过程如下:
是一种重要的化工原料,工业上生产硝酸的主要过程如下: 2NH3(g) △H<0
2NH3(g) △H<0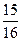 ,则N2的转化率a1= ;
,则N2的转化率a1= ;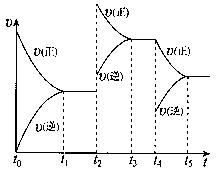

 含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( )
含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( )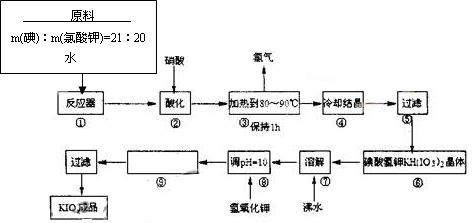
 2NH3(g) ΔH<0;2SO2(g)+O2(g)
2NH3(g) ΔH<0;2SO2(g)+O2(g)