题目内容
(15分)氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子膜都只允许阳离子通过。如下图所示:

(1)①上图中的节能型氯碱工业部分,X、Y分别是_______、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:__________________________;负极:____________________________;
③这样设计的主要节(电)能之处在于(写出2处)_______________、____________。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式 。
(3)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2Ti03,写出该反应的化学方程式 。
(4)已知:①Mg(s)+Cl2 (g)=MgCl2 (g) △H=-641kJ·mol-1
②1/2Ti(s)+Cl2 (g)=1/2TiCl4 (l) △H="-385" kJ·mol-1
写出Mg与TiCl4反应的热化学方程式 ,
反应在氩气氛中进行的理由是 。

(1)①上图中的节能型氯碱工业部分,X、Y分别是_______、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:__________________________;负极:____________________________;
③这样设计的主要节(电)能之处在于(写出2处)_______________、____________。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式 。
(3)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2Ti03,写出该反应的化学方程式 。
(4)已知:①Mg(s)+Cl2 (g)=MgCl2 (g) △H=-641kJ·mol-1
②1/2Ti(s)+Cl2 (g)=1/2TiCl4 (l) △H="-385" kJ·mol-1
写出Mg与TiCl4反应的热化学方程式 ,
反应在氩气氛中进行的理由是 。
(1)①Cl2,H2(2分)a%<b% (1分) ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O(2分)③燃料电池可以补充电解池消耗的电能;提高产品碱液的浓度,降低能耗(其他合理答案也给分)(2分)
(2)2FeTiO3+6C+7Cl2
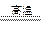 2FeCl3+2TiCl4+6CO(2分)
2FeCl3+2TiCl4+6CO(2分)(3)TiCl4+3H2O=H2TiO3+4HCl (2分)
(4)2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s);△H="-512" kJ·mol-1(3分)
Mg和Ti都有强还原性,在氩气中可以防止被氧化(1分)
(1)燃料电池中,通入空气一极为正极,通入燃料气一极为负极。①Y为氢气,氢气产生于电解池的阴极,推知产生电解池阳极的X为氯气;负极:H2-2e-+2OH-=2H2O,水增多,OH-减少,变稀,正极:O2+4e-+2H2O=4OH-,水减少,OH-增多,所以正极附近氢氧化钠溶液浓度变大,即a<b。注意,离子膜都只允许阳离子通过(水也不能通过)。(2)由流程图知,反应物为Cl2、C、FeTiO3,生成为FeCl3、TiCl4和CO (3)依题意,四氯化钛与水反应生成钛酸和氯化氢(4)由盖斯定律知,①×2-②×2得热化学反应方程式及反应热。

练习册系列答案
相关题目
 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2
 14
14
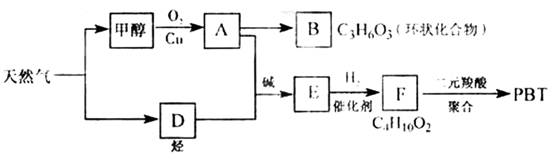
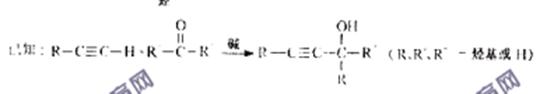
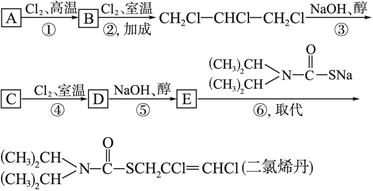
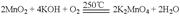 ;
;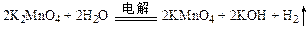 。
。