��Ŀ����
��14�֣����� ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ҫ�������£�
��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ҫ�������£�
��1����N2��H2Ϊԭ�Ϻϳɰ�������ӦN2��g��+3H2��g�� 2NH3��g�� ��H<0
2NH3��g�� ��H<0
�����д�ʩ�������H2��ת�����ǣ���ѡ����ţ� ��
a��ѡ���ʵ��Ĵ��� b������ѹǿ
c����ʱ�������ɵ�NH3 d�������¶�
��һ���¶��£����ܱ������г���1molN2��3molH2������Ӧ���������ݻ��㶨���ﵽƽ��״̬ʱ������������ʵ�����ԭ���� ����N2��ת����a1= ��
����N2��ת����a1= ��
������ѹǿ�㶨���ﵽƽ��״̬ʱ��N2��ת����Ϊa2����a2 a1���>������<����=������
��2������������Ϊ��Ҫԭ�������ᡣ
��NH3����������������NO�ķ�Ӧ�Ļ�ѧ����ʽ�� ��
�����ݻ��㶨���ܱ������н��з�Ӧ2NO��g��+O2��g�� 2NO2��g����H>0
2NO2��g����H>0
�÷�Ӧ�ķ�Ӧ���ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ����ͼ��ʾ����t2��t4ʱ��ֻ�ı�һ������������˵����ȷ���ǣ���ѡ����ţ� ��

a����t1~t2ʱ�������������������ѹǿ���ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
b����t2ʱ����ȡ�Ĵ�ʩ�����������¶�
c����t3~ t4ʱ��������������������ܶȱ��ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
d����t5ʱ��������NO2��������������������е����ֵ
��3�����᳧��������2�ַ�������β����
�ٴ���ԭ������������ʱ��H 2��NO2��ԭΪN2��
2��NO2��ԭΪN2��
��֪��2H2��g��+O2��g��=2H2O��g�� ��H=-483.6kJ/mol
N2��g��+2O2��g��=2NO2��g�� ��H=+67.7kJ/mol
��H2��ԭNO2����ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�ڼ�Һ���շ�����Na2CO3��Һ����NO2����CO2��
��ÿ9.2gNO2��Na2FCO3��Һ��Ӧʱת�Ƶ�����Ϊ0.1mol����Ӧ�����ӷ���ʽ�� ��
 ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ҫ�������£�
��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ҫ�������£���1����N2��H2Ϊԭ�Ϻϳɰ�������ӦN2��g��+3H2��g��
 2NH3��g�� ��H<0
2NH3��g�� ��H<0�����д�ʩ�������H2��ת�����ǣ���ѡ����ţ� ��
a��ѡ���ʵ��Ĵ��� b������ѹǿ
c����ʱ�������ɵ�NH3 d�������¶�
��һ���¶��£����ܱ������г���1molN2��3molH2������Ӧ���������ݻ��㶨���ﵽƽ��״̬ʱ������������ʵ�����ԭ����
 ����N2��ת����a1= ��
����N2��ת����a1= ��������ѹǿ�㶨���ﵽƽ��״̬ʱ��N2��ת����Ϊa2����a2 a1���>������<����=������
��2������������Ϊ��Ҫԭ�������ᡣ
��NH3����������������NO�ķ�Ӧ�Ļ�ѧ����ʽ�� ��
�����ݻ��㶨���ܱ������н��з�Ӧ2NO��g��+O2��g��
 2NO2��g����H>0
2NO2��g����H>0�÷�Ӧ�ķ�Ӧ���ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ����ͼ��ʾ����t2��t4ʱ��ֻ�ı�һ������������˵����ȷ���ǣ���ѡ����ţ� ��

a����t1~t2ʱ�������������������ѹǿ���ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
b����t2ʱ����ȡ�Ĵ�ʩ�����������¶�
c����t3~ t4ʱ��������������������ܶȱ��ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
d����t5ʱ��������NO2��������������������е����ֵ
��3�����᳧��������2�ַ�������β����
�ٴ���ԭ������������ʱ��H
 2��NO2��ԭΪN2��
2��NO2��ԭΪN2����֪��2H2��g��+O2��g��=2H2O��g�� ��H=-483.6kJ/mol
N2��g��+2O2��g��=2NO2��g�� ��H=+67.7kJ/mol
��H2��ԭNO2����ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�ڼ�Һ���շ�����Na2CO3��Һ����NO2����CO2��
��ÿ9.2gNO2��Na2FCO3��Һ��Ӧʱת�Ƶ�����Ϊ0.1mol����Ӧ�����ӷ���ʽ�� ��
��1���٣�2�֣�bc
�ڣ�2�֣�12.5%
��2�֣�>
��2���٣�2�֣�4NH3+5O2

�ڣ�2�֣�ab
��3���٣�2�֣�4H2(g)+2NO2(g)=N2(g)+4H2O(g) ��H=-103.9kJ/mol
�ڣ�2�֣�2NO2+CO32-=NO3-+NO2-+CO2
��

��ϰ��ϵ�д�
 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
�����Ŀ
 2ZnO��2SO2 2C��O2
2ZnO��2SO2 2C��O2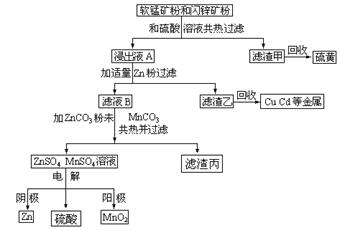

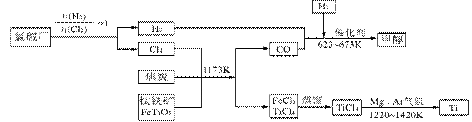
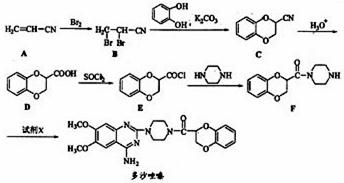
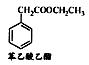 �������������úϳ�·������ͼ��ʾ����ע����Ӧ��������
�������������úϳ�·������ͼ��ʾ����ע����Ӧ�������� CH3CH2OH
CH3CH2OH 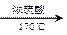 H2C��CH2 BrH2C��CH2Br
H2C��CH2 BrH2C��CH2Br