题目内容
11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
分析 根据价层电子对互斥理论确定分子空间构型,价层电子对数=成键电子对数+孤电子对数,分子中孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,据此分析解答
解答 解:A.SO2中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有2个孤电子对,所以二氧化硫为V型结构,CS2、HI为直线形结构,故A错误;
B.BF3中价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,所以为平面三角形结构,键角为120°;NH3中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含有一个孤电子对,为三角锥型结构,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以NH3的键角小于120°,故B错误;
C.BF3中价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,所以为平面三角形结构,SO3中中心原子价层电子对个数都是3且不含孤电子对,所以分子结构为平面三角形,故C正确;
D.NH3、PCl3中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含有一个孤电子对,所以NH3、PCl3为三角锥形结构;PCl5中价层电子对个数=5+$\frac{1}{2}$×(5-5×1)=5且不含孤电子对,为三角双锥结构,故D错误;
故选C.
点评 本题考查了分子空间构型及键角,明确价层电子对互斥理论的作用是解本题关键,难点是计算孤电子对的方法,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.化学与社会、生活密切相关,下列有关说法不正确的是( )
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
2.恒温条件下用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
19.具有下列电子排布式的原子中,半径最大的是( )
| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
3.下列离子化合物的电子式书写不正确的是( )
| A. | 氯化钙 | B. | 硫化钠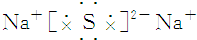 | ||
| C. | 氟化钾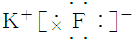 | D. | 过氧化钠 |
20.下列各组比较中正确的是( )
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
1.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 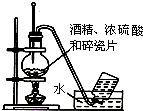 实验室用乙醇制取乙烯 | B. |  实验室制取乙酸乙酯 | ||
| C. | 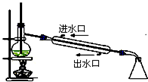 石油分馏 | D. | 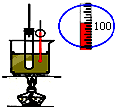 实验室制取硝基苯 |
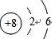 .
.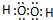 ,化合物XYZ的结构式
,化合物XYZ的结构式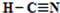 .
.