题目内容
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化 |
| C.每生成1 molCu2S,有4mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
C
解析试题分析:A、正确;B、CuFeS2中铜铁均为+2价,硫为-2价,铜化合价降低,硫化合价升高,故CuFeS2既作还原剂也作氧化剂,硫元素被氧化,正确;C、每生成1 molCu2S,有1mol硫被氧化,错误;D、每个硫原子化合价变化6,故每转移1.2 mol电子,有0.2 mol硫被氧化,正确。
考点:考查氧化还原反应的有关概念、电子转移等有关问题。

将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72-> Fe3+>SO2 |
| B.能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
下列过程中不涉及氧化还原反应的是( )
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价。对于此反应,下列说法正确的是
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
Cu和稀硝酸反应中,若有63g 硝酸被还原了,则被氧化的铜的物质的量为
A.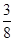 mol mol | B. mol mol | C.3mol | D.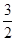 mol mol |
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2 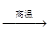 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是
| A.TiO2是氧化剂 |
| B.氧化剂与还原剂的物质的量之比为1:1 |
| C.Cl2发生氧化反应 |
| D.当2 mol C参加反应时,转移的电子数目为2 mol |
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| B.2HCl+Ca(OH)2=CaCl2+2H2O |
| C.5Cl2+I2+6H2O=10HCl+2HIO3 |
D.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |