题目内容
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72-> Fe3+>SO2 |
| B.能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
C
解析试题分析:A选项氧化剂大于氧化产物,可以推出Cr2O72-> Fe3+>SO2,正确。B选项最终生成Na2SO4 ,正确。C选项1 mol K2Cr2O7参加反应生成Cr3+,应转移电子的数目为6NA,错误。D选项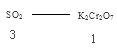 ,0.3molSO2应消耗0.1 mol K2Cr2O7
,0.3molSO2应消耗0.1 mol K2Cr2O7
考点:氧化还原的性质传递及电子转移的换算。

为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、 pH4.5、pH6.6。某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
| A.H2O2,ZnO | B.氨水 | C.KMnO4,ZnCO3 | D.NaOH溶液 |
有关下列三个化学反应的叙述,氧化产物和还原产物物质的量之比为2:1的是
①2H2S+SO2=3S+2H2O ②S+2H2SO4(浓)=3SO2↑+ 2H2O
③3S+6KOH= 2K2S+K2SO3+3H2O
| A.① | B.①② | C.②③ | D.①②③ |
某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素
| A.一定被氧化 | B.一定被还原 |
| C.可能被氧化可能被还原 | D.以上都不是 |
制取新型水处理剂ClO2的化学方程式为( )
2KClO3+H2C2O4+H2SO4 2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
| A.KClO3在反应中得到电子 | B.ClO2是还原产物 |
| C.H2C2O4 在反应中被氧化 | D.1mol KClO3参加反应有2mol电子转移 |
下列说法正确的是
| A.盐酸既有氧化性,又有还原性 |
| B.金属离子被还原一定得到金属单质 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判断不正确的是
| A.若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 |
| B.若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) |
| C.若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol |
| D.KNO3的氧化性强于N2 |
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2 SO4(s)+SO2(g) [N(CH3)4]2 S2O6(s)
[N(CH3)4]2 S2O6(s)
下列说法正确的是
| A.[N(CH3)4]+中只含σ键 |
| B.该反应中,SO2作氧化剂 |
| C.SO2漂白品红是利用其强氧化性 |
| D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化 |
| C.每生成1 molCu2S,有4mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |