题目内容
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| B.2HCl+Ca(OH)2=CaCl2+2H2O |
| C.5Cl2+I2+6H2O=10HCl+2HIO3 |
D.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
A
解析试题分析:A、HCl中一1价的氯反应后一部分化合价变为0价,被氧化;B、该反应中氯化合价没变,不是氧化还原反应;C、氯由0价变为一1价,化合价降低,被还原;D、反应后KClO3中氯由+5价变为一1价,被还原。
考点:本题考查氧化还原反应,考查考生对概念的掌握情况。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2 SO4(s)+SO2(g) [N(CH3)4]2 S2O6(s)
[N(CH3)4]2 S2O6(s)
下列说法正确的是
| A.[N(CH3)4]+中只含σ键 |
| B.该反应中,SO2作氧化剂 |
| C.SO2漂白品红是利用其强氧化性 |
| D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化 |
| C.每生成1 molCu2S,有4mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化,下列说法不正确的是( )
| A.上述过程中,最终被还原的是NO3- |
| B.从上述反应可以得出结论,氧化性:HNO3>Fe3+>稀硫酸 |
| C.上述过程中,会产生一种无色难溶于水的气体 |
| D.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为1:1 |
美蓝(主要成分是亚甲蓝)有较强的还原性,可用做亚硝酸盐中毒的解毒剂,已知亚硝酸盐中毒原理是它会使普通血红蛋白中的铁元素由二价变为三价,失去携氧能力,下列有关说法不正确的是
| A.亚硝酸盐有强氧化性 |
| B.普通血红蛋白有较强氧化性 |
| C.亚硝酸盐中毒后,使用美蓝,高铁血红蛋白被还原 |
| D.中毒与解毒过程中都发生了氧化还原反应 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3 + 2HI = 2FeCl2+ I2 + 2HCl;
2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2FeCl2 + Cl2 = 2FeCl3
复分解反应: 2CH3COOH + K2CO3 = 2CH3COOK+ CO2 ↑ + H2O;
KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应: 4NaClO △3NaCl + NaClO4;
NaClO4△NaCl + 2O2↑
下列说法不正确是( )
| A.氧化性(酸性溶液):Co(OH)3 >FeCl3 > I2 |
| B.还原性(酸性溶液):FeCl2 > HI > HCl |
| C.酸性(水溶液):CH3COOH >H2CO3 >HCN |
| D.热稳定性:NaCl>NaClO4>NaClO |
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
已知NO2遇水发生反应:2NO2 + H2O → HNO2 + HNO3。实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。下列说法错误的是
| A.HNO2非常不稳定,其分解产物为NO和H2O |
| B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C.HNO2的酸性弱于碳酸的酸性 |
| D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为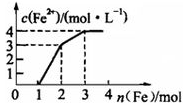
| A.1∶1∶3 | B.1∶2∶4 | C.1∶1∶4 | D.1∶3∶1 |