题目内容
12.从下列实验事实所得出的相应结论正确的是( )| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
分析 ①品红溶液褪色,气体具有漂白性;
②燃烧的镁条放入CO2中能继续燃烧,发生2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
③白色沉淀为氢氧化铝;
④氮气中N≡N的键能大;
⑤产生的气体能使湿润红色石蕊试纸变蓝,气体为氨气.
解答 解:①品红溶液褪色,气体具有漂白性,气体为氯气、二氧化硫等,故错误;
②燃烧的镁条放入CO2中能继续燃烧,发生2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,Mg失去电子,C得到电子,可知还原性:Mg>C,故正确;
③白色沉淀为氢氧化铝,则酸性:HCO3->Al(OH)3,故正确;
④氮气中N≡N的键能大,而非金属性N>P,故错误;
⑤产生的气体能使湿润红色石蕊试纸变蓝,气体为氨气,可知该晶体中一定有NH4+,故正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子检验、氧化还原反应及酸性和非金属性比较为解答本题关键,侧重分析与实验能力的考查,注意元素化合物、反应原理与实验的结合,题目难度不大.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA | |
| D. | 标准状况下,2.24 L已烷含有分子的数目为0.1NA |
3.下列说法正确的是( )
| A. | 用广泛pH试纸测得某溶液的pH为0 | |
| B. | 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 | |
| C. | 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
7.下列有关硝酸的说法中,正确的是( )
| A. | 将可调高度的铜丝伸入稀硝酸中,溶液变蓝,说明Cu与稀硝酸发生置换反应 | |
| B. | 稀硝酸可除去试管内壁的银镜 | |
| C. | 常温下,将浓硝酸滴加到用砂纸打磨过上,会产生红棕色气体 | |
| D. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,则会有气体生成,溶液呈红色,说明稀硝酸将Fe氧化为Fe3+ |
17.某研究性学习小组设计了用化学电源使LED灯发光的装置,示意图如图.下列说法不正确的是( )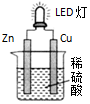

| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌质量减少65g时,铜电极表面析出氢气是22.4L | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
1.在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | NH4+、SO42-、Al3+、Cl- | B. | Na+、OH-、K+、Cl- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、NO3-、I-、Na+ |
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.