题目内容
17.某研究性学习小组设计了用化学电源使LED灯发光的装置,示意图如图.下列说法不正确的是( )
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌质量减少65g时,铜电极表面析出氢气是22.4L | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,正极发生还原反应生成氢气,以此解答该题.
解答 解:A.锌片作负极,发生氧化反应,电子从锌片经导线流向正极铜片,故A正确;
B.铜片作正极,发生还原反应,铜片上有气泡产生,是氢离子在铜片上得电子被还原,故B正确;
C.没有指明标况,不能计算,故C错误;
D.该装置中化学能转化为电能而产生电流,电流通过LED时,LED发光,则装置中存在“化学能→电能→光能”的转换,故D正确;
故选C.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是( )
| A. | Fe2+ | B. | Fe3+ | C. | Al3+ | D. | NH4+ |
12.从下列实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
2.下列有关实验的描述正确的是( )
| A. | Fe(OH)3胶体的制备:将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液.继续煮沸至溶液呈红褐色,停止加热 | |
| B. | 乙酸乙酯的制备:在一支试管中加入3mL浓硫酸,然后慢慢加入2mL无水乙醇和2mL无水乙酸,加入几粒沸石用酒精灯小火加热 | |
| C. | 碳酸钠溶液的焰色反应:用铂丝直接蘸取碳酸钠溶液,在外焰上灼烧,观察火焰颜色 | |
| D. | 在纯锌与稀H2SO4反应中滴入少量的Cu(NO3)2溶液后生成H2的反应速率加快 |
9.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是
 ( )
( )
 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
6.二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水.
二甲酸钾的生产工艺流程如下:
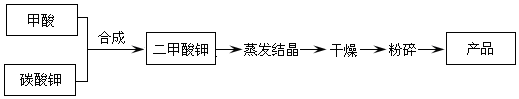
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
表2 反应物料比对产品回收率的影响
备注:表2中反应物料比为甲酸和无水碳酸钾的物质的量之比.
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在50℃∽60℃,反应物料比应选择4:1.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是温度过高,甲酸易挥发.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol•L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL.
①加入的指示剂是酚酞(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色.
②上述弗米产品中二甲酸钾的质量分数为96.2%.
二甲酸钾的生产工艺流程如下:

(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1 反应温度对产品回收率的影响
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82. 6 | 83.6 | 84.5 | 84.8 |
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O.
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在50℃∽60℃,反应物料比应选择4:1.由表1可知反应温度过高,反应回收率反而会降低,其原因可能是温度过高,甲酸易挥发.
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol•L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL.
①加入的指示剂是酚酞(选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色.
②上述弗米产品中二甲酸钾的质量分数为96.2%.
 .其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).
.其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”). .
. ③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.
③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.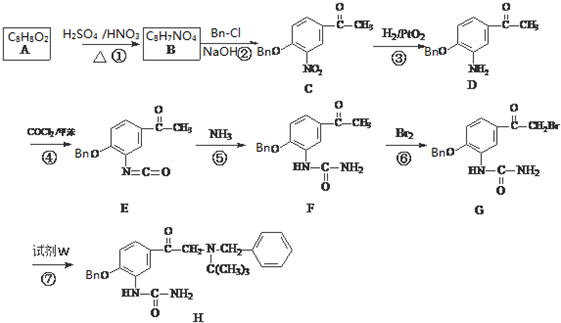
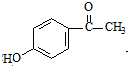 W
W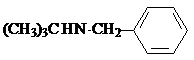 .
.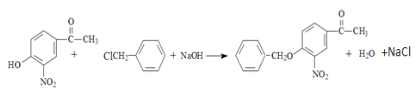 .
.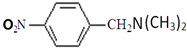 (无机试剂任用)
(无机试剂任用)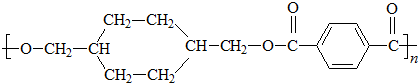
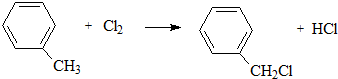
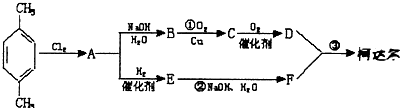
 、D
、D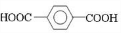 、E
、E ;
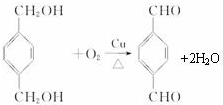
;
 ;
; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$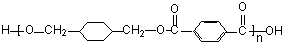 +(2n-1)H2O.
+(2n-1)H2O.