题目内容
【题目】已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯,其合成路线如下,回答下列问题:
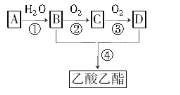
⑴写出A、C的名称________、_________。
⑵B、D分子中的官能团化学式分别是__________、__________。
⑶写出下列反应的反应类型:
①______________,④____________。
⑷写出下列反应的化学方程式:
①__________________;
②__________________;
③___________________。
【答案】乙烯 乙醛 -OH -COOH 加成反应 取代(酯化)反应 CH2 = CH2+ H2O![]() C2H5OH 2C2H5OH + O2
C2H5OH 2C2H5OH + O2 ![]() 2CH3CHO + 2H2O 2CH3CHO + O2
2CH3CHO + 2H2O 2CH3CHO + O2 ![]() 2CH3COOH
2CH3COOH
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应得到B,B为CH3CH2OH,B能氧化得到C,C继续氧化得到D,C为CH3CHO,D为CH3COOH,乙醇与乙酸发生酯化反应得到乙酸乙酯,以此分析解答。
(1)根据上述分析,A为CH2=CH2,名称为乙烯,C为CH3CHO,名称为乙醛,故答案为:乙烯;乙醛;
(2)B为CH3CH2OH,D为CH3COOH,B、D分子中的官能团名称分别是羟基、羧基,化学式分别为-OH、-COOH,故答案为:-OH;-COOH;
(3)反应①是乙烯与水发生加成反应生成乙醇,反应④是乙醇与乙酸发生酯化反应生成乙酸乙酯,故答案为:加成反应;酯化反应(或取代反应);
(4)反应①的化学方程式为:CH2=CH2+H2O ![]() CH3CH2OH,反应②的化学方程式:2CH3CH2OH+O2
CH3CH2OH,反应②的化学方程式:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;反应③的化学方程式为:2CH3CHO + O2
2CH3CHO+2H2O;反应③的化学方程式为:2CH3CHO + O2 ![]() 2CH3COOH,故答案为:CH2=CH2+H2O
2CH3COOH,故答案为:CH2=CH2+H2O ![]() CH3CH2OH;2CH3CH2OH+O2
CH3CH2OH;2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;2CH3CHO + O2
2CH3CHO+2H2O;2CH3CHO + O2 ![]() 2CH3COOH。
2CH3COOH。

 阶梯计算系列答案
阶梯计算系列答案【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率