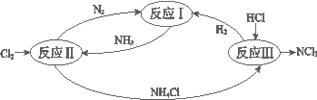
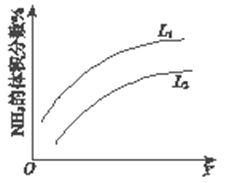
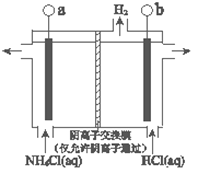
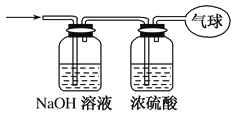
题目内容
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
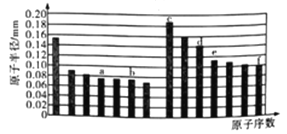
A. a的最高价氧化物与e的最高价氧化物结构相似,都为酸性氧化物且不能与任何酸反应
B. b、c、d、f四种元素的简单离子半径比较: f>b>c>d
C. c、d分别与f组成的化合物均为离子化合物
D. a、f的氧化物对成的水化物酸性及气态氢化物的稳定性f>a
【答案】B
【解析】根据短周期主族元素原子半径与原子序数的关系图可知,a、b、c、d、e、f分别为C、O、Na、Al、Si、Cl。A. C的最高价氧化物为二氧化碳,Si的最高价氧化物为二氧化硅,二氧化硅为原子晶体,而二氧化碳为分子晶体,结构不相似,故A错误;B. 电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,b、c、d、f四种元素的简单离子半径比较: f>b>c>d,故B正确;C. 氯化钠为离子化合物,而氯化铝为共价化合物,故C错误;D. C、Cl的氧化物对成的水化物酸性不一定满足f>a,如次氯酸的酸性<碳酸,故D错误;故选B。

【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
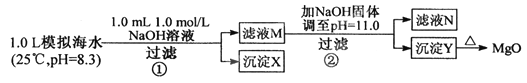
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物