题目内容
【题目】下图表示氮及其化合物在一定条件下的转化关系:
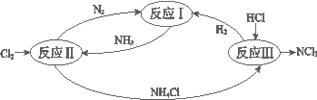
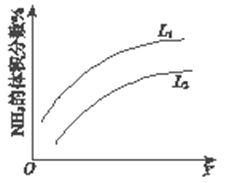
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
(2)反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g)+6HCl(g)ΔH=–462 kJmol-1
已知:![]() 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
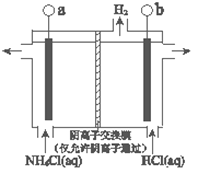
(3)反应III是利用下图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______(填“正”或“负”)。
②阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,该反应的离子方程式是_______。
【答案】 压强 L1<L2 82.0 负 3Cl-+NH4+-6e-=NCl3+4H+ 3H2O+NCl3+6ClO2-=ClO2+NH3+3Cl-+3OH-
【解析】(1)N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1为放热反应,若升高温度平衡逆向移动,前期的体积分数减小,与图像不符;若增大压强,平衡向正向移动,氨气的体积分数增大,故改变条件为压强;压强相同时,温度升高,平衡逆向移动,氨的体积分数减小,L1<L2,故答案为:压强;L1<L2;
(2)设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和,-462=6x+3×243-(945+6y),x-y=41kJ,则断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为82kJ,故答案为:82;
(3)①b极产生氢气,为阴极,与电源负极相连,故答案为:负;
②阴极电极反应为氢离子得电子生成氢气,用总反应减掉阴极反应得阳极反应式,故答案为:3Cl--6e-+NH4+=NCl3+4H+;
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,根据氧化还原化合价升降原理,Cl元素化合价有升高和讲点,根据得失电子守恒配平反应,故答案为:NCl3+6ClO2-+3H2O=6ClO2+NH3+3Cl-+3OH-。

 名校课堂系列答案
名校课堂系列答案【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
【题目】生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾(K2SO4) | 0.25 | 174 |
高锰酸钾(KMnO4) | 0.25 | 158 |
阿司匹林(C9H8O4) | 0.17 | 180 |
硝酸银(AgNO3) | 0.02 | 170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是________(填字母)。
a.蔗糖 b.硫酸钾
c.高锰酸钾 d.硝酸银
(2)欲配制480 mL该鲜花保鲜剂,现已提供下列仪器:
①胶头滴管、②量筒、③烧杯、④药匙、⑤电子天平,如要完成实验,缺少的玻璃仪器还有________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:________(不必化简)。
(4)将m g蔗糖完全燃烧后的产物通过足量的Na2O2固体,充分反应后,固体增加的质量________(填“>”“=”或“<”)m g。