题目内容
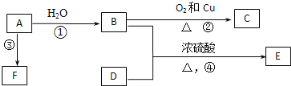
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④ _________________________________________;
⑤ _________________________________________。
(3)写出C溶液与Al反应的化学方程式____________________。
(4)浓硫酸具有强氧化性却可以用B材料车运输,是因为_________________。
(5)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_____________。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
【答案】NaHCl2NaOH+2H2O=2Na++2OH-+H2↑2Fe2++Cl2=2Fe3++2Cl-Fe3++3OH-=Fe(OH)3↓2Al+2NaOH+2H2O=2NaAlO2+3H2↑铁和浓硫酸发生钝化B
【解析】
金属单质A的焰色反应为黄色,则A是Na,黄绿色气体乙是Cl2,Na和水反应生成NaOH和H2,则甲是H2、C是NaOH,氢气和氯气反应生成HCl,所以丙是HCl,D是盐酸,D和金属B反应生成E,E能被氯气氧化生成F,F和NaOH反应生成红褐色沉淀,则红褐色沉淀是Fe(OH)3,所以F是FeCl3、E是FeCl2、B是Fe,再结合物质的性质分析解答。
根据以上分析可知A是Na,B是Fe,C是NaOH,D是盐酸,E是FeCl2、F是FeCl3,甲是H2,乙是Cl2,丙是HCl,红褐色沉淀是Fe(OH)3,则
(1)通过以上分析知,A是Na,丙是HCll;
(2)反应①是Na和水反应生成NaOH和H2,离子反应方程式为2NaOH+2H2O=2Na++2OH-+H2↑;反应④是氯化亚铁和氯气反应生成氯化铁,离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-;反应⑤是氯化铁和氢氧化钠反应生成氢氧化铁,离子方程式为Fe3++3OH-=Fe(OH)3↓;
(3)铝能溶于氢氧化钠溶液生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)常温下铁在浓硫酸中钝化,所以浓硫酸虽具有强氧化性却可以用铁质材料车运输;
(5)铁与稀盐酸反应生成氯化亚铁和氢气,则
A. 碘水不能氧化亚铁离子,不能检验亚铁离子,A错误;
B. NaOH溶液与亚铁离子反应生成氢氧化亚铁白色沉淀,然后迅速转化为灰绿色,最终转化为红褐色,可以检验亚铁离子,B正确;
C. KSCN溶液与亚铁离子不反应,不能检验亚铁离子,C错误;
D. Na2SO3溶液与亚铁离子不反应,不能检验亚铁离子,D错误。
答案选B。