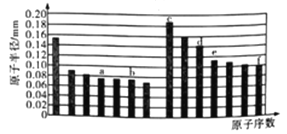
题目内容
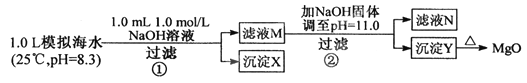
【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物
【答案】A
【解析】A、已知加入1.0L 1.0mol/LNaOH溶液后,溶液中n(OH-)=10-3mol,根据离子的性质,OH-首先与HCO3-发生反应,由题中的数据可知,OH-恰好与1.0L海水中的HCO3-完全反应生成10-3mol的CO32-,所以沉淀x不是Mg(OH)2,又Qsp(CaCO3)=0.011×10-3=1.1×10-5 > Ksp(CaCO3)=4.96![]() 10-9 ,Qsp(MgCO3)=0.050×10-3=5.0×10-5 < Ksp(MgCO3)=6.82
10-9 ,Qsp(MgCO3)=0.050×10-3=5.0×10-5 < Ksp(MgCO3)=6.82![]() 10-5,所以沉淀x中没有MgCO3,只有CaCO3,即A正确;B、由于n(CO32-)=10-3mol,则消耗的n(Ca2+)=10-3mol,所以滤液M中还有剩余的n(Ca2+)=0.010mol,故B错误;C、再加NaOH固体调节溶液的pH=11.0,此时c(OH-)=10-3mol·L-1,则Qsp(Ca(OH)2) =0.010×10-6=1.0×10-8 < Ksp(Ca(OH)2)= 4.68
10-5,所以沉淀x中没有MgCO3,只有CaCO3,即A正确;B、由于n(CO32-)=10-3mol,则消耗的n(Ca2+)=10-3mol,所以滤液M中还有剩余的n(Ca2+)=0.010mol,故B错误;C、再加NaOH固体调节溶液的pH=11.0,此时c(OH-)=10-3mol·L-1,则Qsp(Ca(OH)2) =0.010×10-6=1.0×10-8 < Ksp(Ca(OH)2)= 4.68![]() 10-6,所以没有Ca(OH)2沉淀,而Qsp(Mg(OH)2) =0.050×10-6=5.0×10-8 > Ksp(Mg(OH)2)= 5.61
10-6,所以没有Ca(OH)2沉淀,而Qsp(Mg(OH)2) =0.050×10-6=5.0×10-8 > Ksp(Mg(OH)2)= 5.61![]() 10-12,则有Mg(OH)2沉淀生成,且溶液中的c(Mg2+)=5.61
10-12,则有Mg(OH)2沉淀生成,且溶液中的c(Mg2+)=5.61![]() 10-6mol·L-1 <1.0
10-6mol·L-1 <1.0![]() 10-5mol
10-5mol![]() L-1,所以滤液N中不存在Mg2+,存在Ca2+,故C错误;D、步骤②中改为加入4.2g NaOH固体,则n(OH-)=0.105mol,而溶液中的n(Mg2+)=0.050mol,所以反应生成Mg(OH)2沉淀后,溶液中剩余的c(OH-)=0.005mol/L,c(Ca2+)=0.010mol·L-1,则Qsp(Ca(OH)2) =0.010×(0.005)2=2.5×10-7 < Ksp(Ca(OH)2)= 4.68
L-1,所以滤液N中不存在Mg2+,存在Ca2+,故C错误;D、步骤②中改为加入4.2g NaOH固体,则n(OH-)=0.105mol,而溶液中的n(Mg2+)=0.050mol,所以反应生成Mg(OH)2沉淀后,溶液中剩余的c(OH-)=0.005mol/L,c(Ca2+)=0.010mol·L-1,则Qsp(Ca(OH)2) =0.010×(0.005)2=2.5×10-7 < Ksp(Ca(OH)2)= 4.68![]() 10-6,所以沉淀Y中没有Ca(OH)2沉淀,只有Mg(OH)2沉淀,故D错误。本题正确答案为A。
10-6,所以沉淀Y中没有Ca(OH)2沉淀,只有Mg(OH)2沉淀,故D错误。本题正确答案为A。

【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
【题目】生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾(K2SO4) | 0.25 | 174 |
高锰酸钾(KMnO4) | 0.25 | 158 |
阿司匹林(C9H8O4) | 0.17 | 180 |
硝酸银(AgNO3) | 0.02 | 170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是________(填字母)。
a.蔗糖 b.硫酸钾
c.高锰酸钾 d.硝酸银
(2)欲配制480 mL该鲜花保鲜剂,现已提供下列仪器:
①胶头滴管、②量筒、③烧杯、④药匙、⑤电子天平,如要完成实验,缺少的玻璃仪器还有________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:________(不必化简)。
(4)将m g蔗糖完全燃烧后的产物通过足量的Na2O2固体,充分反应后,固体增加的质量________(填“>”“=”或“<”)m g。