题目内容
11.钡和钠相似,也能形成O22-离子的过氧化物,则下列叙述错误的是( )| A. | 1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气 | |
| B. | 过氧化钡的化学式是Ba2O2 | |
| C. | 过氧化钡是离子化合物 | |
| D. | 过氧化钠和过氧化钡都是强氧化剂 |
分析 A.1 mol过氧化钠或过氧化钡跟足量水反应都生成氧气时,有一半的过氧根离子失电子生成氧气;
B.过氧化钡的化学式是BaO2;
C.过氧化钡中含有离子键,属于离子化合物;
D.过氧化钠和过氧化钡都具有强氧化性.
解答 解:A.1 mol过氧化钠或过氧化钡跟足量水反应都生成氧气时,有一半的过氧根离子失电子生成氧气,所以1 mol过氧化钠或过氧化钡跟足量水反应都生成0.5 mol氧气,故A正确;
B.过氧化钡中过氧根离子化合价为-2价、钡离子化合价为+2价,所以过氧化钡的化学式是BaO2,故B错误;
C.过氧化钡中过氧根离子和钡离子之间存在离子键、过氧根离子中O原子之间存在共价键,属于离子化合物,故C正确;
D.过氧化钠和过氧化钡中过氧根离子具有强氧化性,所以过氧化钠和过氧化钡都是强氧化剂,故D正确.
故选B.
点评 本题以过氧化物为载体考查氧化还原反应,侧重考查分析计算能力,以过氧化钠为例采用知识迁移方法解答即可,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
1.一定条件下在固定体积的密闭容器中,能表示反应X(g)+2Y(g)?2Z(g)一定达到化学平衡状态的是( )
| A. | X、Y、Z的物质的量之比为1:2:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 容器中的压强不再发生变化 | |
| D. | 单位时间内生成n mol Z,同时生成2n mol Y |
16.用初中电解水的实验装置电解水和重水(D2O)组成的混合液,通电一段时间后,在两极共收集到33.6L(标准状况)气体,总质量为18.5g,则混合气体中H原子和D原子个数之比( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 4:1 |
3.已知:H2(g)+F2(g)→2HF(g)+270KJ,下列说法正确的是( )
| A. | 2L HF气体分解成1L H2和1L F2吸收270KJ热量 | |
| B. | 1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270KJ | |
| C. | 在相同条件下1mol H2与1mol F2的能量总和大于2mol HF气体的能 | |
| D. | 1个氢分子与1个氟分子反应生成2个氟化氢分子放出279KJ能量 |
10.下列有关实验操作或判断不正确的是( )
| A. | 用10mL量筒量取稀硫酸溶液 8.0mL | |
| B. | 用干燥的pH试纸测定氯水的pH | |
| C. | 用碱式滴定管量取KMnO4溶液 19.60mL | |
| D. | 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大 | |
| E. | 圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上 |
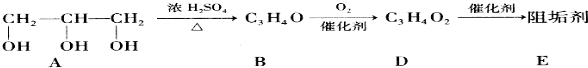
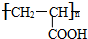 ;其反应类型为加聚反应;
;其反应类型为加聚反应;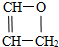 .
.