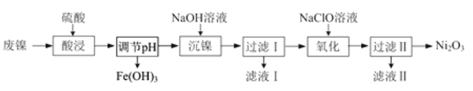
��Ŀ����
����Ŀ��̼��һ�ּ�����Ҫ��Ԫ�أ���ҵ�ϣ������е����ɼ���
(1)̼ԭ�Ӻ�����________��������ͬ�ĵ��ӣ���Щ����ռ����______���Ĵ��ι����
(2)���з������ԱȽ�̼����ķǽ�����ǿ������__________
a���Ƚ�ԭ���������������� b���Ƚ�������������Ӧˮ���������
c���Ƚ���̬�⻯����ȶ��� d���Ƚϵ��ʵ��۷е�ߵ�
(3)ú��������ú��Ч�ྻ���õķ���֮һ����һ���¶��µ�ij�ݻ��ɱ���ܱ������� �������л�ѧƽ�⣺C(s)��H2O(g)![]() CO(g)��H2(g)��Q�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����_____��ѡ����ţ���
CO(g)��H2(g)��Q�����϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬����_____��ѡ����ţ���
a����ϵ��ѹǿ���ٷ����仯 b��v��(CO)��v��(H2O)
c������n molCO��ͬʱ����n mol H2������d��1mol H��H������ͬʱ����2mol H��O��
(4)��������ѧƽ��״̬������Ӧ��ʼ�������ﵽƽ���ƽ����ϵ��ѹ����С���)���������������ƽ����Է���������______����д���䡢��С�������ȷ����������ҵ���Դ˷�������ˮú������߲��ʵĴ�ʩΪ____����д��������ʩ��
(5)�����е�CO2Ũ�����ᵼ������ЧӦ�����������CO2ͨ���ܵ����͵����ף���ɼ���������CO2Ũ�ȵ����ӡ���������ȥ����ˮ������Ҳ����ǿ���ƻ��������̬ϵͳ��������CO2�����ʣ���ƽ��Ƕȷ���������ǿԭ�� _____________________��
���𰸡�3 2 b bd ��� �ʵ���߷�Ӧ�¶ȡ���ʱ���߲��� ����ѹǿ��CO2���ܽ�Ƚ�������ӣ��ҿ���Һ�����ʽ���ڣ����ݷ�Ӧ��CO2��H2O![]() H2CO3 ����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3
H2CO3 ����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3![]() H����HCO3����H2CO3����ƽ�������ƶ�������������ǿ
H����HCO3����H2CO3����ƽ�������ƶ�������������ǿ
��������
(1)̼�ĵ����Ų�ʽΪ1s22s22p2��������3��������ͬ�ĵ��ӣ��Ĵ��ι��p����2�����ӣ�
(2)ͨ���Ƚ�C��SԪ�ص�����������Ӧ��ˮ�������̼������������ǿ����֤������̼�ķǽ����Ե�ǿ����
(3)���ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣻
(4)ƽ���ƶ���ԭ�����������
(5)����ƽ���ƶ���ԭ�����������
(1)̼�ĵ����Ų�ʽΪ1s22s22p2��������3��������ͬ�ĵ��ӣ��Ĵ��ι��p����2�����ӣ�������2���Ĵ��ι�����ʴ�Ϊ��3��2��
(2)����������ԺͿ����Ե�̼���η�Ӧ����֪����������ǿ��̼�ᣬ��Ԫ�ص�����������Ӧ��ˮ���������Խǿ˵����Ԫ�صķǽ�����Խǿ����ѡb��
(3)a����ϵ��ѹǿһֱ�������仯��ѡ��a����
b��v��(CO)=v��(H2O)=v��(H2O)��ѡ��b��ȷ��
c������n molCO��ͬʱ����n mol H2��δ����������Ĺ�ϵ��ѡ��c��������
d��1mol H-H�����ѵ�Ч�ڣ��γ�2mol H-O����ͬʱ����2mol H-O����ѡ��d��ȷ��
��ѡbd��
(4)��������ѧƽ��״̬������Ӧ��ʼ�������ﵽƽ���ƽ����ϵ��ѹ(��С���)���������ǿ��Կ��ӿ�ʼ��Ӧ���ҷ�Ӧ������ƽ����Է���������һ��ˮ�ֽ�Ϊһ��CO��H2�Ǽ��ٵģ����ѹ�Ǵ�������Ӧ����Ȼ�����ʴ�Ϊ�����
����Ӧ�����ȷ�Ӧ���ɲ�ȡ�ʵ���߷�Ӧ�¶ȣ���ʱ���߲���ʴ�Ϊ���ɲ�ȡ�ʵ���߷�Ӧ�¶ȡ���ʱ���߲��
(5)����ѹǿ��CO2���ܽ�Ƚ�������ӣ��ҿ���Һ�����ʽ���ڣ����ݷ�Ӧ��CO2��H2O![]() H2CO3����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3
H2CO3����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3![]() H����HCO3����H2CO3����ƽ�������ƶ�������������ǿ���ʴ�Ϊ�����ݷ�Ӧ��CO2+H2O
H����HCO3����H2CO3����ƽ�������ƶ�������������ǿ���ʴ�Ϊ�����ݷ�Ӧ��CO2+H2O![]() H2CO3����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3
H2CO3����ˮ��Ӧ�̶�����ƽ�������ƶ�������̼�����࣬����H2CO3![]() H����HCO3������ƽ�������ƶ�������������ǿ��
H����HCO3������ƽ�������ƶ�������������ǿ��

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�����Ŀ���Ȱ�����������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����������������ˮ���������ش��������⣺
(1)��һ�Ȱ�(NH2Cl)�ĵ���ʽΪ ________________ ��
�ڹ�ҵ�Ͽ����÷�ӦCl2(g)+NH3(g)=NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ�����費ͬ������ͬ�ֻ�ѧ���ļ�����ͬ������÷�Ӧ����H=________��
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����(kJ/mol) | 391 | 243 | 191 | 431 |
��һ�Ȱ�����Ҫ��ˮ����������ԭ��������һ�Ȱ������ԡ����Ի����лᷢ��ˮ�⣬���ɾ���ǿ��ɱ���������õ����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________��
(2)��Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (��������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ټ������У�0��40 min����NH3��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NH3)=___________��
�ڸ÷�Ӧ����H________0(����>������<��) ��
�۶Ը÷�Ӧ������˵����ȷ����______________(��ѡ����ĸ����
A���������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B����������Cl2��NH3���ʵ���֮�Ȳ��䣬�������Ӧ�ﵽƽ��״̬
C����Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ����������Cl2��ת��������
D����Ӧ�ﵽƽ��������������䣬����һ������NHCl2��ƽ�����淴Ӧ�����ƶ�
(3)�ں��������£�2molCl2��1molNH3������Ӧ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
NHCl2(l)+2HCl(g)�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B��C������Cl2ת������ߵ���______��(����A����B������C��)��(��ʾ��C��ʱHCl��Cl2��Ũ�����)
�ڼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=_________(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)