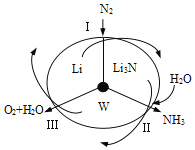
题目内容
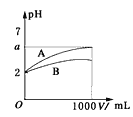
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。据图信息回答:

(1)该温度时NH3·H2O的电离常数K=________。
(2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为________。
【答案】10-5 d>c>b
【解析】
(1)根据开始时pH计算c(H+),再根据Kw中c(H+)、c(OH-)的关系计算溶液的c(OH-),结合NH3·H2O的电离平衡计算平衡时溶液的各种微粒的浓度,代入平衡常数表达式,可计算出K的大小;
(2)滴定时,由b点到c点的过程中,根据水的离子积常数、氨水的电离平衡、氯化铵的水解平衡只与温度有关来分析。
(1)滴定前氨水pH=11,则溶液中c(H+)=10-11mol/L,利用水的离子积得c(OH-)=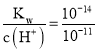 mol/L=10-3mol/L,在氨水中存在电离平衡:NH3·H2O
mol/L=10-3mol/L,在氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,则一水合氨的电离平衡常数K=
NH4++OH-,则一水合氨的电离平衡常数K= =
=![]() ≈10-5;
≈10-5;
(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;
在c点时,溶质为氨水和氯化铵,氨水的电离程度等于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响;
在d点时,溶质为氯化铵,氯化铵发生水解,使溶液显酸性,对水的电离平衡起促进作用,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序是:d>c>b。

 阅读快车系列答案
阅读快车系列答案【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小