题目内容
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
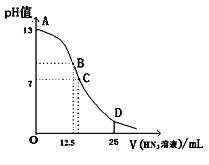
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
【答案】B
【解析】
A.HN3是一元弱酸,与NaOH等物质的量反应得到的盐是强碱弱酸盐,溶液显碱性,所以滴定时要选择在碱性条件下变色的指示剂酚酞,不能使用酸性范围变色的指示剂甲基橙,A错误;
B.在B点时NaOH与HN3恰好发生中和反应产生NaN3,根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(N3-),由于NaOH、HN3的体积已知,所以c(Na+)=(25mL× 0.1 mol/L)÷(25+12.5)mL=0.067mol/L,此时溶液的pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,可得c(N3-)=c(Na+)+c(H+)-c(OH-)= c(Na+)+10-8-10-6,再根据物料守恒可得c(HN3)+ c(N3-)=c(Na+),所以c(HN3)=(10-6~10-8 )mol/L,B正确;
C. D点时HN3的物质的量是NaOH的2倍,溶液为NaN3、HN3等物质的量关系混合,此时溶液中存在HN3的电离作用和N3-的水解作用,根据图示可知此时溶液显酸性,说明HN3的电离作用大于N3-的水解作用,所以c(N3-)>c(Na+),HN3由于电离而消耗,因此c(Na+)>c(HN3),因此溶液中微粒浓度关系为c(N3-)>c(Na+)>c(HN3),C正确;
D.在A点溶液为NaOH溶液,NaOH是碱,抑制水的电离,随着HN3的加入,溶液的碱性逐渐减弱,水电离程度逐渐增大,当到B点时酸碱恰好中和,水电离程度达到最大值,后再向溶液中加入HN3,这时随着酸的加入,溶液逐渐变为酸性,酸对水的电离起抑制作用,水电离程度由逐渐减小,因此沿曲线A→B→C的过程中,由水电离产生的c(OH-)先逐渐增大到B点时最大,后又逐渐减少,D错误;
故合理选项是B。

【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(S)+2NO(g)+Cl2(g) K2
2NaNO3(S)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________________;
(2)已知几种化学键的键能数据如下表(NO分子中氮氧键键能为630 kJ/mol,亚硝酸氯的结构为Cl-N=O):
化学键 | N | Cl-Cl | Cl-N | N=O |
键能/kJmol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的△H3和a的关系为△H3=________;
2ClNO(g)反应的△H3和a的关系为△H3=________;
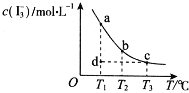
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl(g),在不同温度下测得c(ClNO)与时间的关系如图A:
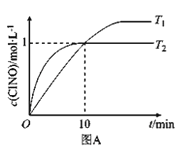
①由图A可判断T1________T2,该反应的△H________0(填“>”“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=________;
③T2时该反应的平衡常数K=____________;
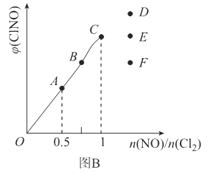
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化如图B,则A、B、C三状态中,NO的转化率最大的是________点。