题目内容
18. 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为第二周期第VA族.
根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:
H3AsO4<,H3PO4;H2Se与HBr稳定性强弱H2Se<HBr (用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为+6、-2
(3)用电子式表示二氧化碳分子的形成过程:
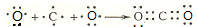 .
.
分析 (1)N元素有2个电子层,最外层电子数为5,同主族,从上到下非金属性减弱,则最高价含氧酸的酸性越弱;
(2)S位于第ⅥA族,最高价为+6价,最低价为-2价;
(3)二氧化碳属于共价化合物,二氧化碳分子中C与每个O形成两对共有电子对,据此写形成过程.
解答 解:(1)N元素有2个电子层,最外层电子数为5,位于元素周期表中第二周期第ⅤA族;同主族,从上到下非金属性减弱,则最高价含氧酸的酸性越弱,非金属性As<P,则酸性H3AsO4<H3PO4,非金属性越强,氢化物稳定性越强,非金属性Se<Br,所以稳定性H2Se<HBr,
故答案为:第二周期第VA族;<;<;
(2)S位于第ⅥA族,最高价为+6价,最低价为6-8=-2价,
故答案为:+6;、-2;
(3)二氧化碳属于共价化合物,分子中C原子与每个O原子之间形成2对共用电子对,所有原子的最外层都满足8电子结构,用C原子、O原子的电子式表示其形成为: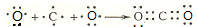 ,
,
故答案为: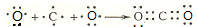 .
.
点评 本题考查位置结构性质的关系及应用,难度不大,注意掌握电子式表示物质的形成或化学键的形成过程.

练习册系列答案
相关题目
3.鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子,其中有6个双键且不含环状结构,则其分子式为( )
| A. | C30H60 | B. | C30H56 | C. | C30H52 | D. | C30H50 |
6.已知β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.
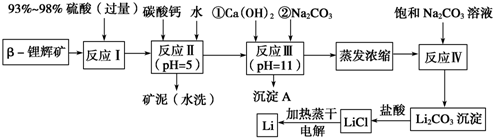
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.
10.水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
c.检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
7.NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 0.1 mol C3H6Cl2中化学键总数为NA | |
| B. | 42 g乙烯中含碳原子数为3 NA | |
| C. | 标准状况下,1L苯完全燃烧生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 NA |
8.检验在空气中露置一段时间的FeSO4溶液中是否含有Fe3+,可选用的试剂是( )
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | 酸性KMnO4溶液 | D. | 盐酸 |