题目内容
【题目】在密闭容器中充入5 mol CO和4 mol NO,发生反应: 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
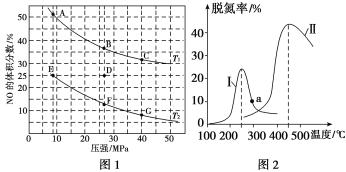
A.温度:T1<T2
B.若在D点对反应容器降温的同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中G点
C.E点时NO的平衡转化率为50%
D.a点是对应温度下的平衡脱氮率
【答案】BC
【解析】
A. 该反应的正反应为放热反应,升高温度,化学平衡逆向移动,NO的体积分数增大,由于NO的体积分数在温度为T1高于温度为T2时的体积分数,所以温度T1>T2,A错误;
B. 若在D点对反应容器降温的同时缩小体积使体系压强增大,化学平衡正向移动,NO的体积分数会减小,重新达到的平衡状态可能是图中G点,B正确;
C. 在反应开始时在密闭容器中充入5 mol CO和4 mol NO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),达到平衡假设反应产生N2的物质的量是x,则同时产生CO2的物质的量为2x,NO的物质的量为(4-2x) mol,CO的物质的量为(5-2x) mol,根据图象可知此时NO的体积分数为25%,则
N2(g)+2CO2(g),达到平衡假设反应产生N2的物质的量是x,则同时产生CO2的物质的量为2x,NO的物质的量为(4-2x) mol,CO的物质的量为(5-2x) mol,根据图象可知此时NO的体积分数为25%,则![]() =25%,解得x=1 mol,所以反应的NO物质的量为2x=2 mol,则NO的平衡转化率为
=25%,解得x=1 mol,所以反应的NO物质的量为2x=2 mol,则NO的平衡转化率为![]() ×100%=50%,C正确;
×100%=50%,C正确;
D. 由于该反应的正反应为放热反应,降低温度平衡正向移动,平衡脱氮率增大,根据曲线II可知:a点不是对应温度下的平衡脱氮率,a点对应温度下的平衡脱氮率应该更高,D错误;
故答案选BC。

【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。