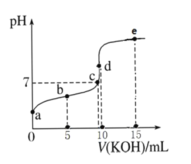
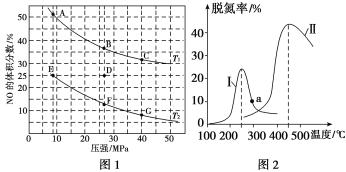
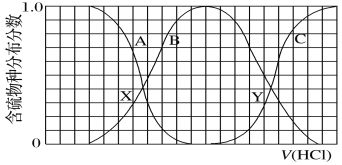
题目内容
【题目】A、B都是短周期元素,原子最外层电子排布式分别为![]() 。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
(1)比较电离能:
①![]() _____
_____ ![]() (填“>”或“<”,下同)
(填“>”或“<”,下同)
②![]() _____
_____ ![]() 。
。
(2)通常A元素的化合价是 _____________ ,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释:_____________ 。
②用电离能的观点进行解释:______________ 。
(3)写出D跟水反应的离子方程式: _________ 。
【答案】< < +1 钠原子失去一个电子后核外电子排布式为ls22s22p6,原子轨道处于全充满状态,该+1价阳离子体系能M低,极难再失去电子 Na原子的第一电离能相对较小,第二电离能比第一电离能大很多,通常Na原子只能失去一个电子 ![]()
【解析】
A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3,故x+1=2,解得x=1,故A的外层电子排布式分别为(n+1)s1,处于第ⅠA族,B外层电子排布式分别为ns2np4,处于第ⅥA族,A与B可形成化合物D,D溶于水时有气体逸出,该气体能使带火星的木条复燃,该气体为O2,故化合物D为Na2O2,A为Na,B为O,结合物质性质与元素周期律解答。
(1)同周期自左而右,第一电离能呈增大的趋势,同主族自上而下第一电离能减小。O失去一个电子比Na困难得多,故电离能I1(Na)<I1(O);He是稀有气体元素,原子核外最外层达到了稳定结构,很难失去电子,故I1(O)<I1(He);
(2)Na元素的化合价是+1,
①钠原子失去一个电子后形成电子排布为1s22s22p6,原子轨道全充满的+1价阳离子,该离子结构体系能量低,极难再失去电子,故通常化合价为+1;
②Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍,通常Na原子只能失去一个电子,化合价为+1价;
③过氧化钠跟水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑。

【题目】下列有关实验的操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸 | 生成白色沉淀,加入稀 盐酸,沉淀不溶解 |
|
C | 向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液 | 产生使湿润的红色石蕊试纸变蓝的气体 | NH4++OH- = NH3↑+H2O |
D | 测定等物质的量浓度的Na2CO3和NaClO的pH值 | Na2CO3>NaClO | 酸性:H2CO3<HClO |
A.AB.BC.CD.D