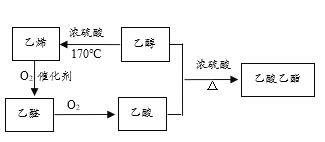
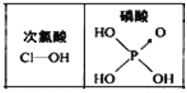
题目内容
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
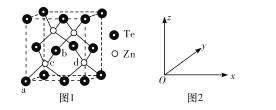
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
【答案】![]() 4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3
4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3 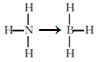 乙烷 ZnTe (
乙烷 ZnTe (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(2)Mn2+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(3)氨气分子中的N原子有3个σ键和1个孤电子对;甲苯分子上甲基的碳原子形成4个σ键,没有孤电子对;氨硼烷中N原子提供孤电子对与B形成氢键,等电子体具有相同的原子数和价电子数,据此分析解答;
(4)①根据均摊法计算解答;②如图坐标中,过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,据此分析解答;③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a结合晶胞质量计算晶体密度。
a结合晶胞质量计算晶体密度。
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9,外围电子排布图为![]() ;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:
;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:![]() ;4;
;4;
(2)Mn的电子排布式为1s22s22p63s23p63d54s2,失去2个电子后达到3d5稳定结构,再失去1个电子较难,而Fe2+的电子排布式为1s22s22p63s23p63d6,失去一个电子后3d变成半充满的稳定状态,所以Mn的第三电离能大于Fe的第三电离能,故答案为:Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子;
(3)氨气分子中的N原子有3个σ键和1个孤电子对,空间构型为三角锥形;甲苯分子上甲基的碳原子形成4个σ键,杂化方式为sp3;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷中N原子提供孤电子对与B形成氢键,结构式为 ;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3;
;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3; ;乙烷;
;乙烷;
(4)①顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×
a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×![]() +6×
+6×![]() =4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
=4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
②如图坐标中,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=
),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=![]() ,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=
,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=![]() ,y=
,y=![]() ,z=
,z=![]() ,即参数坐标为(
,即参数坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,晶胞质量=4×
a×10-10 cm,晶胞质量=4×![]() g=
g=![]() g,晶体密度=
g,晶体密度=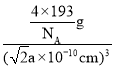 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如图:
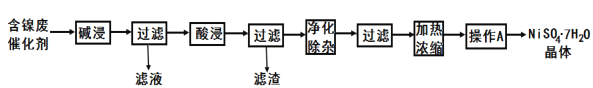
回答下列问题:
(1)滤液中的阴离子为_____。
(2)“酸浸”所使用的酸为_____。
(3)“净化除杂”是为了除铁,需加入H2O2溶液,溶液变成棕黄色,发生反应的离子方程式为__;一段时间后。溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__;然后调节pH就可使溶液中铁元素完全沉淀,若使其刚好沉淀完全(离子浓度为1.0×10-5mol/L),此时的pH=__(保留一位小数)
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)关于铁铝化合物的下列说法正确的是__(填序号)。
①配制FeCl3、AlCl3溶液时,均是先将固体FeCl3、AlCl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3