题目内容
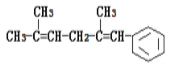
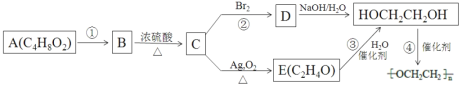
【题目】聚乙二醇![]() )电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
)电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
(1)E 物质的名称是_____。
(2)D 的键线式是_____。
(3)反应④的化学方程式是_____。
(4)下列说法正确的是_____。
a.A 在酸性或碱性条件下都可以反应得到B,反应②中的 Br2 可以是溴水或溴的 CCl4 溶液
b.工业上获得C 的的主要方法是催化裂化
c.可以用饱和碳酸钠溶液除去 B 中混有的少量A
d.反应①的反应类型为水解反应
【答案】环氧乙烷 ![]() nHOCH2CH2OH
nHOCH2CH2OH![]()
![]() +nH2O ad
+nH2O ad
【解析】
烃C中碳与氢元素的质量比为6:1,则C、H原子个数之比为![]() ,是同系物中最简单的物质,应为CH2=CH2,B到C的条件为浓硫酸加热,应为乙醇发生消去反应生成乙烯的过程,则B为CH3CH2OH,结合A的分子式可推知A应为CH3COOCH2CH3;C到D为乙烯的加成反应,则D为CH2BrCH2Br;根据E的分子式结合C的结构,可知E为
,是同系物中最简单的物质,应为CH2=CH2,B到C的条件为浓硫酸加热,应为乙醇发生消去反应生成乙烯的过程,则B为CH3CH2OH,结合A的分子式可推知A应为CH3COOCH2CH3;C到D为乙烯的加成反应,则D为CH2BrCH2Br;根据E的分子式结合C的结构,可知E为![]() 。
。
(1)E的结构简式为![]() ,其名称为环氧乙烷;
,其名称为环氧乙烷;
(2)D的结构简式为CH2BrCH2Br,其键线式为![]() ;
;
(3)反应④为乙二醇的缩聚反应,方程式为nHOCH2CH2OH![]()
![]() +nH2O;
+nH2O;
(4)a.A为乙酸乙酯,在酸性或碱性条件下都可以水解生成乙醇,乙烯可与溴水或溴的四氯化碳溶液发生加成反应,故a正确;
b.工业上获得乙烯的的主要方法是催化裂解,故b错误;
c.乙酸乙酯不溶于碳酸钠溶液也不和碳酸钠反应,无法除去乙醇中的乙酸乙酯,应用蒸馏的方法将二者分离,故c错误;
d.反应①为乙酸乙酯的水解,故d正确;
综上所述选ad。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
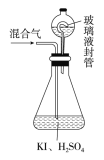
单元期中期末卷系列答案【题目】某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯),反应原理: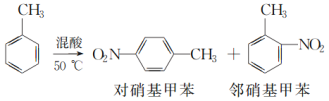
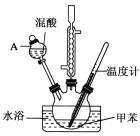
实验步骤:①浓硝酸与浓硫酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈烧瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈烧瓶中加入混酸;
④控制温度约为50~55℃,反应大约10min,三颈烧瓶底部有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
有机物 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)A的仪器名称是___。
(2)水浴加热的优点是__。
(3)配制混酸的方法是__。
(4)若实验后在三颈烧瓶中收集的产物较少,可能的原因是__。
(5)分离反应后产物的方案如下:
混合液![]()
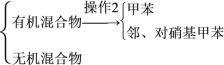
操作1的名称是__,操作2中不需要用到下列仪器中的__(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为__(结果保留至小数点后一位数字)。