题目内容
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
【答案】810a 9.52% 增大 > 正反应放热,升温,平衡逆向移动,气体的物质的量增大 < > < > < > <
【解析】
(1)平衡时,体积为aL,

由题可知,(2-2x)+(1-x)+2x=2.1,解得x=0.9,则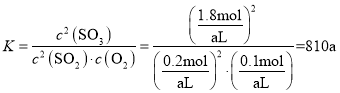 ;
;
(2)由(1)分析可知,反应进行到t1时,SO2的体积分数为![]() ;
;
(3)该反应在恒压装置中进行,充入氩气,氩气不参加反应,因此容器体积将增大,容器内反应物总压将减小,平衡将向气体体积增大的方向移动,即平衡将逆向移动,SO2的物质的量将增大;
(4)该反应正向为放热反应,升高温度,平衡将向吸热反应方向移动,即平衡将逆向移动,达到新平衡混合物中气体的总物质的量大于2.1mol;
(5)恒容条件下,再加入0.2molSO2、0.1molO2和1.8molSO3,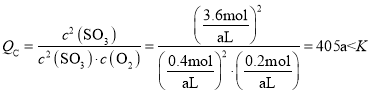 ,反应将正向进行,v逆<v正;
,反应将正向进行,v逆<v正;
(6)由题中表格信息可知,容器2建立的平衡相当于容器1建立平衡后再将容器的容积缩小为原来的![]() (相当于压强增大为原来的2倍)后平衡移动的结果,由于加压,化学反应速率加快,则v1<v2;由于平衡右移,则α1(SO2)<α2(SO2),根据勒夏特列原理可得c2>2c1,p1<p2<2p1;容器3中建立的平衡相当于容器1建立的平衡升温后平衡移动的结果。升高温度,化学反应速率加快,则v1<v3;由于平衡左移,则α1(SO2)>α3(SO2),c1>c3。由于温度升高,气体物质的量增加,故p3>p1。对于特定反应,平衡常数仅与温度有关,温度升高,题给平衡左移,平衡常数减小,则K1=K2>K3,由以上分析可知c2>2c1,p1<p2<2p1,p1<p3,则p2<2p3,v1<v3,α1(SO2)>α3(SO2),因为c2>2c1,c1>c3,则c2>2c3。若容器2的容积是容器1的2倍,则两者建立的平衡完全相同,根据平衡特点,此时应存在α1(SO2)+α2(SO3)=1,由于容器2的平衡相当于容器1的平衡加压,故α2(SO3)将减小,则α1(SO2)+α2(SO3)<1,结合α1(SO2)>α3(SO2),则α2(SO3)+α3(SO2)<1。
(相当于压强增大为原来的2倍)后平衡移动的结果,由于加压,化学反应速率加快,则v1<v2;由于平衡右移,则α1(SO2)<α2(SO2),根据勒夏特列原理可得c2>2c1,p1<p2<2p1;容器3中建立的平衡相当于容器1建立的平衡升温后平衡移动的结果。升高温度,化学反应速率加快,则v1<v3;由于平衡左移,则α1(SO2)>α3(SO2),c1>c3。由于温度升高,气体物质的量增加,故p3>p1。对于特定反应,平衡常数仅与温度有关,温度升高,题给平衡左移,平衡常数减小,则K1=K2>K3,由以上分析可知c2>2c1,p1<p2<2p1,p1<p3,则p2<2p3,v1<v3,α1(SO2)>α3(SO2),因为c2>2c1,c1>c3,则c2>2c3。若容器2的容积是容器1的2倍,则两者建立的平衡完全相同,根据平衡特点,此时应存在α1(SO2)+α2(SO3)=1,由于容器2的平衡相当于容器1的平衡加压,故α2(SO3)将减小,则α1(SO2)+α2(SO3)<1,结合α1(SO2)>α3(SO2),则α2(SO3)+α3(SO2)<1。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案


