题目内容
【题目】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g)![]() 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__。
(2)合成NH3达到平衡后,某时刻改变下列条件__(填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)

①图象中T2和T1的关系是:T2__T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
T1 | 30% | 50% | 80% | 80% |
T2 | 35% | 60% | a | b |
上表中a、b、80%三者的大小关系为___。(填“>”“=”“<”或“无法比较”)
【答案】(1.5c-a-b)kJ A < c 0.02 a=b<80%
【解析】
(1)根据盖斯定律计算反应的焓变,根据反应放出的热量与物质的量成正比;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动;
(3)①根据温度升高化学平衡向着吸热方向进行;
②根据a、b、c三点所表示的意义来回答;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,但温度低,反应速率慢。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=(2a+2b-3c)kJ·mol-1;
则34g 即2mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为![]() ×[-(2a+2b-3c)] kJ=(1.5c-a-b)kJ ;
×[-(2a+2b-3c)] kJ=(1.5c-a-b)kJ ;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,所以改变条件应为升温,反应速率增大,平衡逆向移动,而加压、增大c(N2)、降低c(NH3)平衡都正向移动,故选A;
(3)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氨气的分数增加,故T1>T2,即:T2<T1;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,
故选c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当起始氢气的物质的量为0.15mol时氨的含量最大,故起始加入N2的物质的量为0.05mol,所以起始时氮气的浓度是0.05mol·L-1,平衡时0.05mol·L-1×(1-60%)=0.02mol·L-1;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,所以a>80%,但温度低,反应速率慢,所以T2时反应可能达到平衡也可能未达平衡,所以a=b或a<b,所以80%<a=b或80%<a<b。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
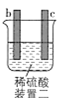
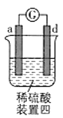
芒果教辅暑假天地重庆出版社系列答案【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()