题目内容
【题目】在一定条件下CO2与NH3混合反应,可以合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
CO(NH2)2(s)+H2O(g) ΔH,若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是( )
A.CO2与H2O(g)浓度相等
B.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆
D.容器中混合气体的密度不再改变
【答案】BD
【解析】
A.反应平衡时CO2与H2O(g)浓度均不在改变,但不一定相等,故A错误;
B.该反应正反应为气体体积减少的反应,而容器的体积不变,所以平衡移动时容器内压强会发生改变,当压强不变时说明反应达到平衡,故B正确;
C.平衡时v(NH3)正=v(NH3)逆,2v(H2O)逆= v(NH3)逆,所以2v(NH3)正=v(H2O)逆不能说明反应达到平衡,且对于该反应,该关系不可能成立,故C错误;
D.容器体积恒定,平衡正向移动时气体的质量减少,即平衡移动时气体的密度会发生改变,所以当密度不变时说明反应平衡,故D正确;
故答案为BD。

【题目】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g)![]() 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__。
(2)合成NH3达到平衡后,某时刻改变下列条件__(填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
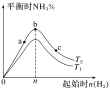
①图象中T2和T1的关系是:T2__T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
T1 | 30% | 50% | 80% | 80% |
T2 | 35% | 60% | a | b |
上表中a、b、80%三者的大小关系为___。(填“>”“=”“<”或“无法比较”)