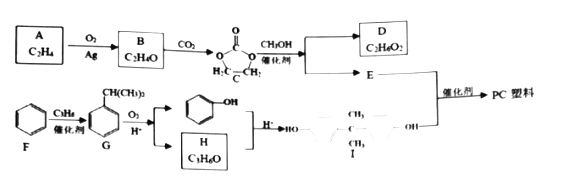
题目内容
【题目】现有下列十种物质:
①0.1mol/L硫酸、②小苏打、③纯碱、④二氧化碳、⑤葡萄糖、⑥0.1mol/LNaOH溶液、 ⑦氢氧化铁胶体、⑧氨水、⑨Al2O3、⑩硫酸铁溶液
(1)上述十种物质中,属于非电解质的有___(填序号)。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,这两种物质的序号是___(填序号)。
(3)既能跟盐酸反应又能跟NaOH溶液反应的是___(填序号)。
(4)现有100mL⑩溶液中含Fe3+5.6g,则溶液中c(SO42-)=___。
【答案】④⑤ ①⑥ ②⑨ 1.5mol/L
【解析】
(1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)离子方程式为:H++OH-═H2O,可表示强酸与强碱反应生成可溶性盐和水的离子反应;
(3)氧化铝为两性氧化物、碳酸氢钠为酸式盐,既能够与盐酸反应又能跟NaOH溶液反应;
(4)根据n=![]() 计算Fe3+的物质的量,溶液中2n(SO42-)=3n(Fe3+),再根据c=
计算Fe3+的物质的量,溶液中2n(SO42-)=3n(Fe3+),再根据c=![]() 计算SO42-的物质的量浓度。
计算SO42-的物质的量浓度。
(1)①0.1mol·L-1硫酸为混合物,不是电解质也不是非电解质,故①错误;
②NaHCO3在水溶液或者熔融状态下能够导电,是电解质,故②错误;
③碳酸钠在水溶液或者熔融状态下能够导电,是电解质,故③错误;
④二氧化碳水溶液中反应生成电解质溶液导电,本身不能电离属于非电解质,故④正确;
⑤葡萄糖在水溶液和熔融状态下都不能够导电,是非电解质,故⑤正确;
⑥0.1mol·L-1NaOH 溶液为混合物,不是电解质也不是非电解质,故⑥错误;
⑦氢氧化铁胶体属于混合物 既不是电解质也不是非电解质,故⑦错误;
⑧氨水属于混合物 既不是电解质也不是非电解质,故⑧错误;
⑨Al2O3在熔融状态下能够导电,属于电解质,故⑨错误;
⑩硫酸铁溶液属于混合物 既不是电解质也不是非电解质,故⑩错误;
故选④⑤;
(2)离子方程式H++OH-═H2O表示强酸与强碱反应生成可溶性盐和水的离子反应,如①0.1mol·L-1 硫酸与⑥0.1mol·L-1NaOH 溶液的反应,
故选①⑥;
(3)②小苏打为酸式盐,Al2O3是两性氧化物,二者既能跟盐酸反应又能跟NaOH 溶液反应,
故选②⑨;
(4)Fe3+的物质的量为![]() =0.1mol,溶液中2n(SO42-)=3n(Fe3+),则SO42-的物质的量为0.1mol×
=0.1mol,溶液中2n(SO42-)=3n(Fe3+),则SO42-的物质的量为0.1mol×![]() =0.15mol,SO42-的物质的量浓度为:
=0.15mol,SO42-的物质的量浓度为:![]() =1.5mol·L-1。
=1.5mol·L-1。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g)![]() 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__。
(2)合成NH3达到平衡后,某时刻改变下列条件__(填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
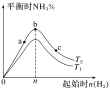
①图象中T2和T1的关系是:T2__T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__(填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
T1 | 30% | 50% | 80% | 80% |
T2 | 35% | 60% | a | b |
上表中a、b、80%三者的大小关系为___。(填“>”“=”“<”或“无法比较”)
【题目】实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·5H2O),方案如下:

金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________L。
(2)加入H2O2的目的是____________。
(3)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为____________。
a.Cu(OH)2 b.H2SO4 c.NH3·H2O d.Na2CO3
(4)滤液D中加入硫酸的目的为_______________________________________。
(5)从溶液E制得CuSO4·5H2O晶体所需要的步骤为________、结晶、过滤和干燥。
(6)0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。试确定200℃时固体物质的化学式______________。