题目内容
【题目】根据要求填空
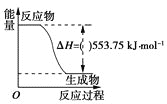
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:__。
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
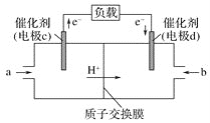
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是__(填“正极”或“负极”),c电极的反应方程式为___。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=___(不考虑溶液体积变化)。
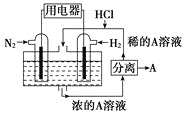
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__,该反应能设计成原电池的原因是__。A是__(填物质名称)。
【答案】C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0kJ/mol 负极 CH3OH-6e-+H2O=CO2+6H+ 13 N2+8H++6e-=2NH4+ 合成氨是放热的氧化还原反应 氯化铵
【解析】
⑴根据图像计算4mol放出的热量,再写丙烷燃烧的热化学方程式。
⑵①由图可知,电子由电极c移动电极b,而在原电池中,电子由负极流向正极,因此c电极为负极;CH3OH在负极发生失电子的氧化反应,生成CO2;②先算0.56L氧气的物质的量,再算反应过程中转移电子数;根据电子转移计算反应生成n(OH-),再计算溶液c(OH-),再计算溶液中c(H+),再计算溶液的pH。
⑶根据反应N2+3H2=2NH3,正极发生的是得电子的还原反应,负极发生氧化反应;合成氨的过程为放热的氧化还原反应可以设计成原电池。
⑴丙烷燃烧的化学方程式为C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l),由图像可知,当反应生成1mol H2O(l)时放出的热量为553.75 kJmol1,因此反应生成4molH2O(l)时放出的热量为553.75kJmol1×4=2215.0 kJmol1,因此该反应的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=2215.0 kJmol1;故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=2215.0 kJmol1。
⑵①由图可知,电子由电极c移动电极b,而在原电池中,电子由负极流向正极,因此c电极为负极;CH3OH在负极发生失电子的氧化反应,生成CO2,反应过程中,碳元素由2价变为+4价,失去6个电子,电解质溶液中使用质子交换膜,只允许H+通过,因此c电极的电极反应式为:CH3OH 6e + H2O = CO2 + 6H+;故答案为:负极;CH3OH 6e + H2O = CO2 + 6H+。
②0.56L氧气的物质的量![]() ,反应过程中转移电子数为0.025mol×4=0.1mol;电解饱和NaCl溶液时,阴极的电极反应式为2H2O+2e- = 2OH-+H2↑,因此反应生成n(OH-)=0.1mol,则溶液中
,反应过程中转移电子数为0.025mol×4=0.1mol;电解饱和NaCl溶液时,阴极的电极反应式为2H2O+2e- = 2OH-+H2↑,因此反应生成n(OH-)=0.1mol,则溶液中![]() ,因此溶液的pH=13;故答案为:13。
,因此溶液的pH=13;故答案为:13。
⑶利用N2和H2进行的固氮反应为N2+3H2=2NH3,正极发生的是得电子的还原反应,因此正极的电极反应式为N2 + 8H+ + 6e = 2NH4+,负极的电极反应式为3H26 e = 6H+;因此可得A为NH4Cl;该反应能设计成原电池是由于合成氨的过程为放热的氧化还原反应;故答案为:N2 + 8H+ + 6e = 2NH4+;合成氨是放热的氧化还原反应;氯化铵。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)26H2O并探究其分解规律。实验步骤如下:
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)26H2O。
V.将(NH4)2Fe(SO4)26H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。
已知在不同温度下FeSO47H2O的溶解度如表:
温度(℃) | 1 | 10 | 30 | 50 |
溶解度(g) | 14.0 | 17.0 | 25.0 | 33.0 |
回答下列问题:
(1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是__,步骤Ⅱ中设计铁粉过量,是为了__,加热反应过程中需不断补充蒸馏水的目的是__。
(2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了__。
(3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为__(气流从左至右);C中盛放的试剂为__。
②装置A的作用是__。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为__。
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请填空:
(1)反应①的K1表达式是___。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
(3)能判断反应③一定处于化学平衡状态的依据是___(填写字母序号)。
A.压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.单位时间内生成H2和H2O(g)的物质的量相等
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
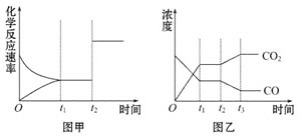
①图甲中t2时刻发生改变的条件是___。
②图乙中t2时刻发生改变的条件是__。
(5)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向__移动(填“不”、“逆反应方向”或“正反应方向”)
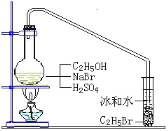
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。
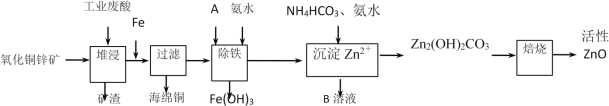
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
已知:各离子开始沉淀及完全沉淀时的pH如表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)加入A物质的目的是___,物质A可使用下列物质中的___。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式:___。
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。
(6)物质B可用作生产化肥,其化学式是___。