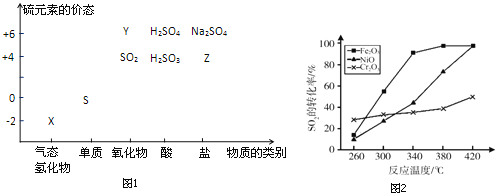
��Ŀ����
����Ŀ����³����(���ӽṹ���ϳ���·)���п������ԣ���һ�ֺϳ�·����ͼ��
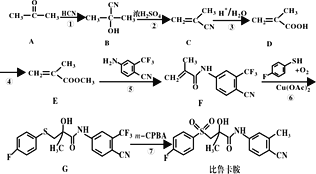
�ش���������
��1��A�Ļ�ѧ����Ϊ__��
��2��D�й����ŵ�������__��
��3����Ӧ�������Լ��������ֱ�Ϊ__��__��
��4��д���ݵķ�Ӧ����ʽ__��
��5��F�ķ���ʽΪ__��
��6��д����E��Ϊͬ���칹�壬�ҷ������������Ļ�����Ľṹ��ʽ__��
�����������������E��ͬ���ں˴Ź�������Ϊ����壬�������Ϊ1��1��6
��7���ο���³�����ϳɵ������Ϣ�������ͼ�ϳ���·(�����Լ���ѡ)___��

���𰸡���ͪ ̼̼˫�����Ȼ� �״� Ũ���ᡢ����  +CH3OH C12H9N2OF3
+CH3OH C12H9N2OF3 ![]()
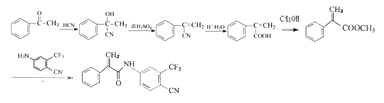
��������
A��HCN�ӳɵõ�B��-H����Oԭ���ϣ�-CN��Cԭ���ϣ�B������ȥ��Ӧ�õ�C��Cˮ��õ�D��E�ͼ״�������Ӧ�õ�E��E����ȡ����Ӧ����F��F�����ӳɡ�������Ӧ����G��G�����ɱ�³������
��1����A�Ľṹ��ʽ��֪��A�ķ���ʽΪ��C3H6O���ʴ�Ϊ��C3H6O��
��2����D�Ľṹ��ʽ��֪��D�к�̼̼˫�����Ȼ����ʴ�Ϊ��̼̼˫�����Ȼ���
��3��D�ͼ״�������Ӧ����E��������Ӧ������ΪŨ���ᡢ���ȣ��ʴ�Ϊ���״���Ũ���ᡢ���ȣ�
��4����ͼ��֪��E�е���������ȡ������F����������Hԭ�������˼״������Է����ķ�ӦΪ�� +CH3OH���ʴ�Ϊ��
+CH3OH���ʴ�Ϊ�� +CH3OH��
+CH3OH��
��5���������ˣ�F�ķ���ʽΪ��C12H9N2OF3���ʴ�Ϊ��C12H9N2OF3��
��6�����������������E��ͬ����һ����̼̼˫�����������˴Ź�������Ϊ����壬�������Ϊ1��1��6�������2������������ȷ���ֲ��ṹ��C-C=C���ڴ˻����ϣ������е��ʻ�ֻ���ܳ�����3��̼�ϣ���ô��ֻ��������һ��̼�ϣ����Է���������ֻ��һ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��7����ϱ��������ϳɲ��յڢݲ���֪��![]() ����
���� ��
��![]() �ϳɣ�
�ϳɣ�![]() ��
��![]() �ͼ״��ϳɣ�
�ͼ״��ϳɣ�![]() ��
��![]() ˮ�������
ˮ�������![]() ��
��![]() ��ȥ������
��ȥ������![]() ��
��![]() ��HCN�ӳɶ�������������
��HCN�ӳɶ������������� ���ʴ�Ϊ��
���ʴ�Ϊ��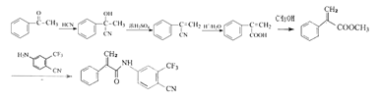 ��
��

����Ŀ��ijУѧϰС���ͬѧ���ʵ�飬�Ʊ���NH4��2Fe��SO4��26H2O��̽����ֽ���ɡ�ʵ�鲽�����£�
��.��ȡ7.0g��ҵ�����۷����ձ��У������ȵ�Na2CO3��Һϴ�ӣ���ˮϴ�������
��.��ȡ6.0g��������������ۼ���25mLijŨ�������м��ȣ����ȹ����в��ϲ�������ˮ������Ӧ��֡�
��.��ȴ�����˲�ϴ�ӹ��������ۣ������������۵�������
��.��������Һ�м���������NH4��2SO4���壬������������ȫ�ܽ⣬��һϵ�в����ø��﴿���ģ�NH4��2Fe��SO4��26H2O��
V.����NH4��2Fe��SO4��26H2O��ˮ�ã�NH4��2Fe��SO4��2���������ȷֽ�ʵ�顣
��֪�ڲ�ͬ�¶���FeSO47H2O���ܽ�������
�¶ȣ��棩 | 1 | 10 | 30 | 50 |
�ܽ�ȣ�g�� | 14.0 | 17.0 | 25.0 | 33.0 |
�ش��������⣺
��1����������ȵ�Na2CO3��Һϴ�ӹ�ҵ�����۵�Ŀ����__���������������۹�������Ϊ��__�����ȷ�Ӧ�������費�ϲ�������ˮ��Ŀ����__��
��2��������г�����Ӧ��ʣ�����۵���������Ϊ��__��
��3����NH4��2Fe��SO4��2�ֽ����̬���������N2��NH3��SO2��SO3��ˮ������������װ�ü��鲿�ֲ��

�ټ�����̬�����е�SO2��SO3ʱ��װ������˳������Ϊ__�������������ң���C��ʢ�ŵ��Լ�Ϊ__��
��װ��A��������__��
�ۼ����ַֽⲢ��ȴ��Ĵ������������������Ƿ��ж����������õ����Լ�Ϊ__��
����Ŀ������һ�ָ���ȼ�ϡ���֪�����ۼ�����(���ѻ��γ�1mol���ۼ�ʱ���ջ��ͷŵ�����)�����
N��N | O=O | N-N | N-H | O-H | |
����(KJmol��1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol��1 ��
(2)�ܱ������н��з�Ӧ��3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
(3)��֪��600��ʱ��������Ӧ��ƽ�ⳣ��K=16��������ͼ��(���º�ѹ)����ͼ��(���º���)��������
��ʼʱ���±���ʾ�ֱ��������ʣ����Ϊ2L����600��ʱ��Ӧ����һ��ʱ������ƽ�⡣
Fe | H2O(g) | Fe3O4 | H2 | |
��/mol | 2.0 | 1.0 | 2.0 | 0.5 |
��/mol | 2.0 | 2.0 | 2.0 | 1.0 |
�ٹ��ڼס������������з���ȷ����________��
A.��Ӧ��ʼʱ�������ڵ��淴Ӧ���ʣ��ף���
B.����������������ܶȲ��ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
C.���������������ѹǿ���ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
D.ƽ�������Fe3O4���������ڵ�ƽ��������ƶ�
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����v(H2)=________��
��ƽ���������������ϵ�¶�ͻȻ����100����ͼ��������ȷ��ӳƽ���ƶ������������ڱ仯�������________��
A.  B.
B.  C.
C. 
(4)��ͼΪ���ݾ���������

����������Ӧ����ʼ��ƽ��ʱ�ĸ����ʵ���������
Fe | H2O(g) | Fe3O4 | H2 | |
��ʼ/mol | 3.0 | 3.0 | 0 | 0 |
ƽ��/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
���ڴﵽƽ�����������У��ֱ�������A��B��C��������������Ӹ����ʣ����ٴδ�ƽ��ʱ����������H2�İٷֺ������ɴ�С��˳��______(��A��B��C��ʾ)��
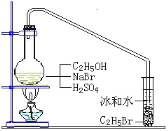
����Ŀ��������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�������Ʊ������飨C2H5Br��ͨ���������·���������ƿ�м�NaBr��Լ2-3g��������ˮ�������Ҵ����ټ��������Ҵ������Ũ���ᣨ1��1�������ϴ��г����ܵ����ӣ������ܵ���һ�˲���װ�б�ˮ�������Թ��У��þƾ��Ƹ�ʯ�����Է�Ӧ����ȣ���ͼ��ʾ�����ô�װ��Ҳ���Ʊ�һЩ������±�������磺1-�嶡��ȡ����ܴ��ڵĸ���Ӧ�У�����Ũ����Ĵ�������ˮ����ϩ���ѣ�Br-��Ũ��������ΪBr2�ȡ��й������б����£���ش��������⣺
�Ҵ� | ������ | ������ | 1-�嶡�� | |
�ܶ�/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
�е�/�� | 78.5 | 38.4 | 117.2 | 101.6 |
(1)д���÷����Ʊ������飨C2H5Br���Ļ�ѧ����ʽ_____
(2)ͼ�е��Թܷ����ˮ������Ŀ����_____��
(3)�Ʊ������У������Ũ����������ϡ�ͣ�Ŀ����_____��
a�����ٸ�����ϩ���ѵ����� b������Br2������
c������HBr�Ļӷ� d��ˮ�Ƿ�Ӧ�Ĵ���
(4)����ȥ������е���������Br2���������������ʺϵ���_____������ĸ����
a��NaI b��NaOH c��NaHSO3 d��KCl
(5)���Ʊ�������ʱ�����ñ߷�Ӧ����������ķ�������������_____�������Ʊ�1-�嶡��ʱȴ���ܱ߷�Ӧ�����������ԭ����_____��