题目内容
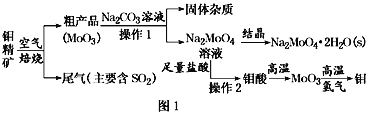
【题目】钨在自然界主要以钨(+6价)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4、MnWO4。黑钨矿冶炼金属钨的流程如下图(已知:钨酸是一种难溶性强酸、对热不稳定)。其中A、B、C都是钨的化合物。完成下列填空:
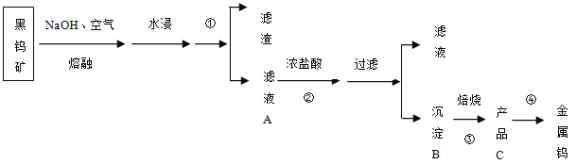
(1)上述从黑钨矿获得单质钨的过程中属于氧化还原反应的是(填数字序号)__________。
(2)操作①的名称为__________,得到的滤液为钨酸的钠盐,写出反应②的化学方程式______________。该过程中产品C为_________,从产品C获得纯度较高的钨的另一反应原料应该为___________。
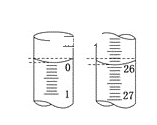
(3)若制得的钨中含有少量金属铁,为测定其中金属钨的含量(已知金属钨不溶于盐酸),甲同学用下列装置进行测定:

相关实验步骤:
①加好称量好的样品和盐酸,记录B的液面位置;
②检查气密性。
③待A中不再有气体产生并恢复至室温后,记录B的液面位置;
④将A中盐酸与样品混合;
正确的操作顺序是_________________(填序号)
(4)若实验用样品的质量为a g,加入20mL盐酸与之充分反应后,测得排出水的体积为VL(标准状况下),测得的H2的体积应为___________L,样品中的钨的质量分数的计算式为______________。
(5)在读取C装置液面数据时,应先____________,再平视读数,若样品中含有不溶于酸,也不与酸反应的物质,则测得钨的质量分数将_________(填“偏大”、“偏小”或“不受影响”)。
【答案】④ 过滤 Na2WO4 + 2HCl = H2WO4 ↓+ 2NaCl WO3 H2或CO ②①④③ V ![]() 调整CD液面相平 偏大
调整CD液面相平 偏大
【解析】
(1)根据个步反应中各物质元素化合价是否发生变化进行判断是不是发生氧化反应;
 分析操作①的分析方法为滤液;根据A
分析操作①的分析方法为滤液;根据A![]() B
B![]() C反应条件和产物书写反应方程式;
C反应条件和产物书写反应方程式;
(3)根据反应原理选择反应步骤;
(4)根据电子守恒和质量守恒进行分析解答;
(5)根据压强原理进行分析;
(1)①②属于复分解反应,③是分解反应;④为WO3制取W,化合价反应发生变化,属于氧化还原反应,故答案为:④;
(2)操作①之后,分为滤渣和滤液,故操作①为过滤;钨酸钠和浓盐酸反应生成钨酸(H2WO4)和氯化钠,其反应的方程式为:Na2WO4 + 2HCl = H2WO4 ↓+ 2NaCl;钨酸(H2WO4)酸性很弱难溶于水,判断B为钨酸(H2WO4),钨酸(H2WO4)加热分解产生三氧化钨(WO3)和水,所以判断C为三氧化钨(WO3),H2、CO还原氧化钨生成钨,故答案:过滤 ; Na2WO4 + 2HCl = H2WO4 ↓+ 2NaCl;WO3;H2或CO;
(3)为测定其中金属钨的含量(已知金属钨不溶于盐酸),首先②检验检查气密性;①然后加入称量好的样品和盐酸;④将A中盐酸与样品混合;③待A中不再有气体产生并恢复至室温后,记录B的液面位置,故答案为:②①④③;
(4)用排水法测定收集H2,测得排出水的体积为VL(标准状况下)则H2的体积也为VL;根据Fe~H2关系,Fe的物质的量=![]() mol,样品中的钨的质量=a-
mol,样品中的钨的质量=a-![]() ,样品中的钨的质量分数=
,样品中的钨的质量分数=
![]() ,所以答案:V;
,所以答案:V;![]() ;
;
(5)读取图C装置液面数据时,应先调整BC液面相平,再平视读数,若样品中含有不溶于酸,也不与酸反应的物质,把此杂质当做钨,则测得钨的质量分数将偏大;
故答案为:调整BC液面相平;偏大。

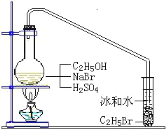
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。