题目内容
【题目】Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15gNa2S2O3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置,水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。

回答问题:
(1)硫粉在反应前用乙醇润湿的目的是___。
(2)仪器a的名称是___,其作用是___。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___,检验是否存在该杂质的方法是___。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因为___。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O32-+I2=S4O62-+2I-。
(5)滴定至终点时,溶液颜色的变化为___。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为___ mL。产品的纯度为___(设Na2S2O35H2O相对分子质量为M)。
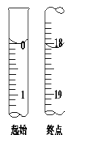
【答案】使硫粉易于分散到溶液中 冷凝管(或球形冷凝管) 冷凝回流 Na2SO4 取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4 ![]() 由无色变为蓝色,且半分钟内不褪色 18.10
由无色变为蓝色,且半分钟内不褪色 18.10 ![]()
【解析】
I.(1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
(2)根据图示装置中仪器构造写出其名称,然后根据冷凝管能够起到冷凝回流的作用进行解答;
(3)由于S2O32具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
(4)S2O32与氢离子在溶液中能够发生氧化还原反应生成硫单质,据此写出反应的离子方程式;
II.(5)滴定终点为最后一滴碘的标准液滴入时,溶液中淀粉遇碘单质变蓝;
(6)滴定管读数从上往下逐渐增大;根据氧化还原反应转移电子守恒解答。
I.(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,故答案为:使硫粉易于分散到溶液中;
(2)根据题中图示装置图可知,仪器a为冷凝管(或球形冷凝管),该实验中冷凝管具有冷凝回流的作用,故答案为:冷凝管(或球形冷凝管);冷凝回流;
(3)![]() 具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4,故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4,故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
(4)![]() 与氢离子发生氧化还原反应生成淡黄色硫单质,反应的离子方程式为:
与氢离子发生氧化还原反应生成淡黄色硫单质,反应的离子方程式为:![]() ;
;
II.(5)因指示剂为淀粉,当滴定到终点时,过量的单质碘遇到淀粉显蓝色,且半分钟内不褪色;
(6)起始体积为0.00mL,终点体积为18.10mL,因此消耗碘的标准溶液体积为18.10mL;该滴定过程中反应的关系式为:![]() ,
,![]() ,则产品的纯度为
,则产品的纯度为![]() 。
。

 阅读快车系列答案
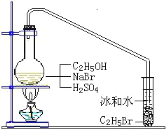
阅读快车系列答案【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。
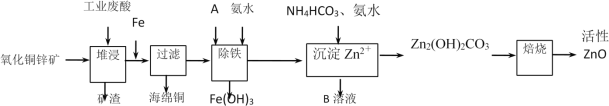
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
已知:各离子开始沉淀及完全沉淀时的pH如表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)加入A物质的目的是___,物质A可使用下列物质中的___。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式:___。
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。
(6)物质B可用作生产化肥,其化学式是___。
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) ΔH=+11 kJ/mol。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) ΔH=+11 kJ/mol。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
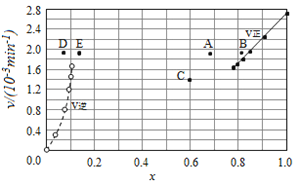
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同


