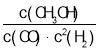题目内容
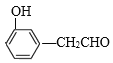
【题目】已知:![]() +CH3CHO+HBr
+CH3CHO+HBr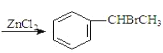 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);
![]() +
+![]()
![]()
![]() +NaX
+NaX
用苯为原料合成化合物Ⅳ的线路如下:
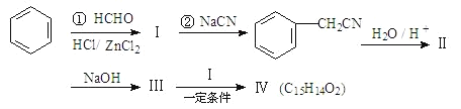
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是________。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)_____、_____。
a.能与FeCl3溶液作用显紫色;
b.能发生银镜反应;
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为 1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2_____mol,化合物Ⅳ的结构简式是__________。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式__________。
【答案】取代反应 ![]()
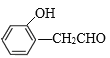 、
、 17.5
17.5 ![]()
![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O
+H2O
【解析】
由题可知①反应为苯与甲醛发生卤烷基化反应,故产物I为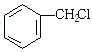 ,②与NaCN发生取代反应产物为
,②与NaCN发生取代反应产物为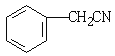 ,在酸性条件下与水反应产物为Ⅱ
,在酸性条件下与水反应产物为Ⅱ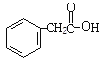 ,与碱中和反应产物为Ⅲ
,与碱中和反应产物为Ⅲ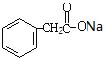 ,后与
,后与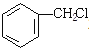 发生取代反应生成产物Ⅳ
发生取代反应生成产物Ⅳ![]() ,据此分析解答。
,据此分析解答。
由题可知①反应为苯与甲醛发生卤烷基化反应,故产物I为 ,②与NaCN发生取代反应产物为
,②与NaCN发生取代反应产物为 ,在酸性条件下与水反应产物为Ⅱ
,在酸性条件下与水反应产物为Ⅱ ,与碱中和反应产物为Ⅲ
,与碱中和反应产物为Ⅲ ,后与
,后与 发生取代反应生成产物Ⅳ
发生取代反应生成产物Ⅳ![]() 。
。
(1)通过以上分析知,②反应类型为取代反应;
(2)化合物Ⅱ的同分异构体,要求a.能与FeCl3溶液作用显紫色,说明该物质具有酚的结构,b.能发生银镜反应,具有醛的结构,c.核磁共振氢谱显示除苯环峰外还有三组峰,峰面积之比为为1:2:1,因此结构中含一羟基、一醛基、一亚甲基;故同分异构体为 、
、 、
、![]() ;
;
(3)化合物Ⅳ化学式为C15H14O2,故1mol化合物Ⅳ完全燃烧消耗O2物质的量n(O2)=(15+![]() -
-![]() )mol=17.5mol,IV的结构简式为
)mol=17.5mol,IV的结构简式为![]() ;
;
(4)化合物Ⅱ为![]() ,与乙醇、浓硫酸共热发生酯化反应,该反应的化学方程式为:
,与乙醇、浓硫酸共热发生酯化反应,该反应的化学方程式为:![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O,
+H2O,
故答案为:![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O。
+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】酸碱中和滴定是中学化学常见实验。
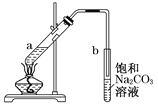
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
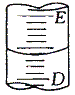
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。