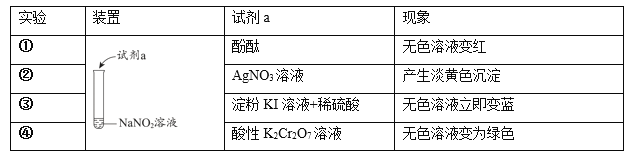
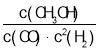题目内容
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
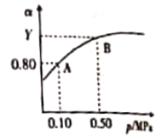
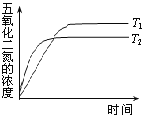
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
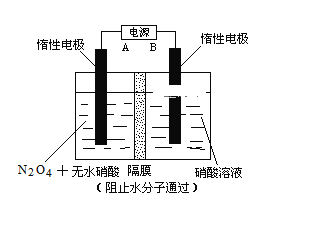
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
【答案】0.00592mol·L-1·s-1 减小 < > 正极 N2O4+2HNO3-2e-=2N2O5+2H+
【解析】
Ⅰ.(1)根据实验数据,结合化学反应速率的定义式![]() 及计算方法求解;
及计算方法求解;
(2)再加入N2O5,相当于加压,结合压强对平衡的影响效果分析;
(3)结合图像,依据 “先拐先平数值大”的规律分析作答;
Ⅱ.阳极发生失电子的氧化反应,N2O4转化为N2O5,化合价升高,据此判断电源的正负极;再依据电解池原理书写电极反应式。
Ⅰ.(1)参加反应的各物质表示的化学反应时速率之比等于化学计量数之比,则500s内NO2的生成速率![]() =0.00592 mol·L-1·s-1;
=0.00592 mol·L-1·s-1;
(2)平衡后再加入一定量的N2O5,增大了体系的压强,会使反应2N2O5(g)![]() 4NO2(g)+O2(g)的平衡向逆反应方向移动,则N2O5的转化率减小;
4NO2(g)+O2(g)的平衡向逆反应方向移动,则N2O5的转化率减小;
(3)从图像中可以看出,反应在T2温度下先达到平衡,则说明在T2温度下反应速率更快,即T1<T2;温度升高,N2O5的浓度降低,则说明升高温度,平衡向正反应方向移动,该反应为吸热反应,ΔH>0,故答案为:<;>;
Ⅱ.制备N2O5气体的电解池装置中,左侧N2O4转化为N2O5,化合价升高,失电子发生氧化反应,则左侧惰性电极为阳极,连接电源的正极,其电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,故答案为:正极;N2O4+2HNO3-2e-=2N2O5+2H+。

 阅读快车系列答案
阅读快车系列答案【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
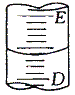
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。