题目内容
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:___。
(2)配平该方程式:__FeC2O4·2H2O+__H2O2+__K2C2O4+__H2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式___;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:K=![]() 。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
【答案】![]() 2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液,若溶液呈血红色则晶体中含有铁元素,反之则无
2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液,若溶液呈血红色则晶体中含有铁元素,反之则无
【解析】
(1)H2O2为共价化合物,其电子式为![]() 。
。
(2)根据水的个数的最小公倍数为6,则FeC2O4·2H2O的化学计量数为2,K3[Fe(C2O4)3]·3H2O的化学计量数为3,然后由原子守恒可知,该化学反应为2FeC2O4·2H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe(C2O4)3]·3H2O,故答案为:2;1;3;1;2;
配平的方程式:_2_FeC2O4·2H2O+_1_H2O2+_3_K2C2O4+_1_H2C2O4=_2_K3[Fe(C2O4)3]·3H2O;
(3)草酸被H2O2氧化生成水和二氧化碳,该反应为H2C2O4+H2O2=2CO2↑+2H2O;
(4)K3[Fe(C2O4)3]·3H2O中的铁为亚铁离子,则不能用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素,检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无。

【题目】部分短周期元素的原子半径及主要化合价如下表:
元素 |
|
|
|
|
|
原子半径/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合价 | +2 | +1 | +2 | +6、-2 | -2 |
下列叙述正确的是( )
A.![]() 一定是金属元素
一定是金属元素
B.原子半径大小:![]()
C.![]() 的简单氢化物的沸点比
的简单氢化物的沸点比![]() 的大
的大
D.![]() 、
、![]() 可能形成阴、阳离子个数比为
可能形成阴、阳离子个数比为![]() 的两种化合物
的两种化合物
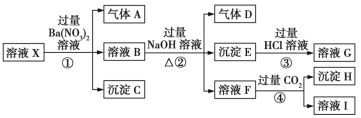
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是____(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)=______;达到平衡时,NO的转化率为_____,气相中NO所占的体积分数为______。