题目内容
【题目】“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4,N2O4与NO2转换的热化学方程式为:N2O4(g)![]() 2NO2(g) △H=+24.4KJ/mol。
2NO2(g) △H=+24.4KJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色____(填“变深”、“变浅”或“不变”),判断理由________。
(2)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时,c(CH4)=0.5mol/L则0~3min内,该反应的平均反应速率v(H2)=___。
CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时,c(CH4)=0.5mol/L则0~3min内,该反应的平均反应速率v(H2)=___。
(3)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:____。
(4)工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。则P1_____P2(填“<”“>”或“=”)
CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。则P1_____P2(填“<”“>”或“=”)

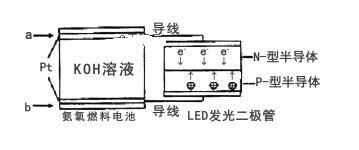
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为:4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为_______。
【答案】bc 变深 正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深 v(H2) = 0.5 moL/(L·min) CH3OH (l)+O2 (g) =CO (g)+2H2O (g) ΔH=-354.8 kJ ∕ mol > 2NH3+6OH-– 6e-=N2 + 6H2O
【解析】
(1)达到平衡状态时,各物质的物质的量、组分浓度和含量均保持不变,结合平衡标志分析;
(2)根据![]() 计算;
计算;
(3)CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,可知表示CH3OH和CO燃烧热的热化学方程式是2CH3OH (l)+3O2 (g) =2CO2 (g)+4H2O (g) ΔH=-1451.6 kJ/mol、2CO (g )+O2(g )═2CO2 (g )△H=-556kJmol-1,根据盖斯定律计算甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式。
(4)增大压强CO(g)+2H2(g) ![]() CH3OH(g)平衡正向移动;
CH3OH(g)平衡正向移动;
(5)根据图示,电子由a极流出,a是负极,a极通入氨气;
(1)a.v正(N2O4)=2v逆(NO2),可知正逆反应速率不相等,故不选a;
b.体系颜色不变,说明NO2浓度不变,一定达到平衡状态,故选b;
c.气体总质量不变,反应前后气体物质的量是变量,平均相对分子质量是变量,若气体平均相对分子质量不变,一定达到平衡状态,故选c;
d.气体质量不变、容器体积不变,根据![]() ,气体密度是恒量,气体密度不变,不一定平衡,故不选d。
,气体密度是恒量,气体密度不变,不一定平衡,故不选d。
N2O4(g)![]() 2NO2(g) △H=+24.4kJ/mol,正反应吸热,升高温度,平衡正向移动,NO2浓度增大,混合气体颜色变深。
2NO2(g) △H=+24.4kJ/mol,正反应吸热,升高温度,平衡正向移动,NO2浓度增大,混合气体颜色变深。
(2)平衡时,c(CH4)=0.5mol/L,则△c(CH4)=1mol/L-0.5mol/L=0.5mol/L,根据方程式,可知则△c(H2)= 1.5mol/L,![]() 0.5 moL/(L·min);
0.5 moL/(L·min);
(3)①2CH3OH (l)+3O2 (g) =2CO2 (g)+4H2O (g) ΔH=-1451.6 kJ/mol、
②2CO (g )+O2(g )═2CO2 (g )△H=-556kJmol-1,
③H2O (g)= H2O (l) ΔH=-44.0 kJ/mol
根据盖斯定律①×![]() -②×
-②×![]() -③×2得CH3OH (l)+O2 (g) =CO (g)+2H2O (g) ΔH=-354.8 kJ ∕ mol。
-③×2得CH3OH (l)+O2 (g) =CO (g)+2H2O (g) ΔH=-354.8 kJ ∕ mol。
(4)增大压强CO(g)+2H2(g) ![]() CH3OH(g)平衡正向移动,压强越大,CH3OH的含量越大,所以P1>P2;
CH3OH(g)平衡正向移动,压强越大,CH3OH的含量越大,所以P1>P2;
(5)根据图示,电子由a极流出,a是负极,a极通入氨气,氨气失电子发生氧化反应,电极反应式是2NH3+6OH-– 6e-=N2 + 6H2O;

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物