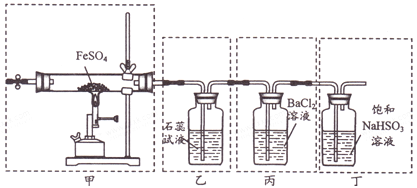
题目内容
【题目】(1)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
①与氯元素同族的短周期元素的原子结构示意图为______。
②能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____。
a. Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
③设计一个实验方案,证明氧化性Cl2>Br2:___________。
(2)铅是碳的同族元素,比碳多4个电子层。
①铅在元素周期表的位置为_______。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________。
【答案】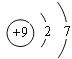 bc 向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2 第六周期ⅣA族 PbO2+4HCl(浓)
bc 向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2 第六周期ⅣA族 PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
【解析】
(1)氯是卤族元素;同一主族元素,元素的非金属性越强,气态氢化物越稳定、单质的氧化性越强、最高价氧化物的水化物酸性越强、与氢气化合越容易;据此分析解答
(2)碳是第2周期第ⅣA族元素;PbO2与浓盐酸共热生成黄绿色气体,说明生成了氯气,结合氧化还原反应的规律分析解答。
(1)①与Cl同一主族是短周期元素是F元素,F原子核外有2个电子层、最外层7个电子,其原子结构示意图为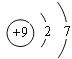 ,故答案为:
,故答案为: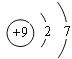 ;
;
②同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其气态氢化物越稳定、单质的氧化性越强、最高价氧化物的水化物酸性越强、与氢气化合越容易,与物理性质无关,故答案为:bc;
③氧化性Cl2>Br2,说明氯气能够置换出溴化物溶液中的溴,因此可以通过:Cl2 + 2NaBr=2NaCl + Br2。设计实验验证,方法和现象为:向溴化钠溶液中通入氯气,溶液由无色变成橙色,故答案为:向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2;
(2)①铅是碳的同族元素,比碳多4个电子层,则铅位于第六周期ⅣA族,故答案为:第六周期ⅣA族;
②PbO2与浓盐酸共热生成黄绿色气体,说明生成了氯气,根据氧化还原反应的规律,还应有PbCl2与水生成,反应的化学方程式为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)
PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案