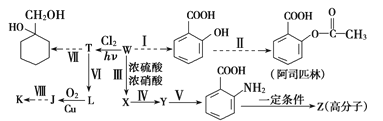
题目内容
【题目】(1)同一物质在气态时的能量大于在液态时的能量。一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______(填“大于”“小于”或“等于”)Q2。
(2)已知:4HCl+O2=2Cl2+2H2O,该反应中,4molHCl被氧化,放出115.6kJ的热量,则断开1molH—O键与断开1molH—Cl键所需能量相差约为______kJ。

(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图:
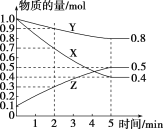
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率之比为3:1
C.容器内气体的压强保持不变
D.容器内气体的总质量保持不变
③0~2min内Y的转化率为________。
【答案】小于 31.9 3X(g)+Y(g)2Z(g) AC 10%
【解析】
(1)氢气燃烧分别生成液态水和气态水,由气态水转化为液态水还要放出热量,故Q1<Q2;
答案为:小于;
(2)用E(H—O)、E(H—Cl)分别表示H—O键、H—Cl键的键能,该反应中,4molHCl被氧化,放出115.6kJ的热量,则反应物总键能-生成物总键能=-115.6kJ·mol-1,故4×E(H—Cl)+498kJ·mol-1-2×243kJ·mol-1-4×E(H—O)=-115.6kJ·mol-1,整理得4E(H—Cl)-4E(H—O)=-127.6kJ·mol-1,即E(H—O)-E(H—Cl)=31.9kJ·mol-1,故断开1molH—O键与断开1molH—Cl键所需能量相差约为31.9kJ·mol-1×1mol=31.9kJ;
答案为:31.9;
(3)①由题图可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到5min时,Δn(Y)=0.2mol,Δn(Z)=0.4mol,Δn(X)=0.6mol,则Δn(Y)∶Δn(Z)∶Δn(X)=1:2:3,则化学方程式中各物质前化学计量数之比为1:2:3,则反应的化学方程式为3X(g)+Y(g)2Z(g);
答案为:3X(g)+Y(g)2Z(g);
②A. Y的体积分数在混合气体中保持不变,则已达平衡,A正确;
B. 平衡时正反应速率和逆反应速率相等,而同一方向的X、Y的反应速率之比始终为3:1,故X、Y的反应速率之比为3:1,不能作为平衡状态的标志,B错误;
C. 反应3X(g)+Y(g)2Z(g)从开始到平衡的过程中,4L容器内的气体物质的量和气体压强始终在变化,当容器内气体的压强保持不变,也即各气体的物质的量保存不变,则已平衡,C正确;
D. 容器内气体的总质量始终保持不变,故容器内气体的总质量保持不变不能作为平衡状态的标志, D错误;
答案为:AC;
③0~2min内Y的转化率=![]() ×100%=
×100%=![]() ×100%=10%;
×100%=10%;
答案为:10%。

 智慧小复习系列答案
智慧小复习系列答案