题目内容
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:
2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
2NO2(g)
 N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |
C
试题分析:两平衡状态相比较发现,新平衡相当于在原平衡基础上压强增大1倍时达到的平衡,此时平衡正向移动。A、平衡右移,NO2的转化率增大,混合气体的物质的量减小、总的质量不变,则
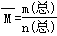 增大,正确;B、平衡右移,NO2的转化率增大,正确;C、平衡右移,NO2的转化率增大,混合气体的总的质量不变,NO2的质量分数减小,错误;D、由于平衡右移,容器中充入2amolNO2达到平衡时,反应的NO2比同容器中充入amolNO2达到平衡时反应的NO2的2倍还多,所以放出的总热量大于原来的2倍,正确。故选C。
增大,正确;B、平衡右移,NO2的转化率增大,正确;C、平衡右移,NO2的转化率增大,混合气体的总的质量不变,NO2的质量分数减小,错误;D、由于平衡右移,容器中充入2amolNO2达到平衡时,反应的NO2比同容器中充入amolNO2达到平衡时反应的NO2的2倍还多,所以放出的总热量大于原来的2倍,正确。故选C。
练习册系列答案
相关题目
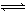 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是 C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是
 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的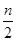 )
) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( ) zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白: 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: 4C(1)+2D( g)。平衡时测得n(C)="1.6mol" ,反应的化学平衡常数表达式为
4C(1)+2D( g)。平衡时测得n(C)="1.6mol" ,反应的化学平衡常数表达式为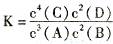
 CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)