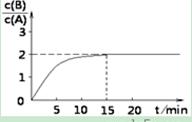
题目内容
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
(1)915℃、2.0MPa时E的转化率为 。
(2)该反应的△S 0(填“>”、“<”或“=”,下同),b f。
(3)平衡常数K(1000℃) K(810℃) ,理由是 。
(4)对于上述反应,下列说法正确的是 (填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
E(g)+F(s)
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
(2)该反应的△S 0(填“>”、“<”或“=”,下同),b f。
(3)平衡常数K(1000℃) K(810℃) ,理由是 。
(4)对于上述反应,下列说法正确的是 (填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
(1)60%(2分)
(2)>(1分);<(1分)
(3)>(1分);
该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大(1分)
(4)①④(2分,漏选得1分,错选不得分);
(2)>(1分);<(1分)
(3)>(1分);
该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大(1分)
(4)①④(2分,漏选得1分,错选不得分);
试题分析:(1)假设一开始加入的E的物质的量为amol
E(g) + F(s)
 2G(g)
2G(g)起始: amol 0mol
变化: bmol 2bmol
平衡:(a-b)mol 2bmol
依题意有:
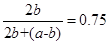
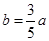
915℃、2.0MPa时E的转化率为:60%
(2)该反应中由1mol的E生成2mol 的F,也就是说是一个熵增的方向,因此△S >0(1分);第二个空中使用控制变量法,先比较a和b的大小,对于这个反应来讲,温度一定条件下,压强越大,转化率越小,因此有: b <a<54℅,那么从表中可以看出,在二个大气压下,从上到下,随温度的升高,数值应该是越来越大,因此有b <a<54℅<75℅<f 。(3)从上到下温度越来越高,G的含量越来越大,意味着温度升高,平衡正向移动,表明正向是一个吸热的方向,因此平衡常数K(1000℃)> K(810℃);
(4)①混合气体的密度不再变化,那么反应物F的量不再变化,意味着各反应物和生成物的浓度都不再变化成了一定值,反应达到平衡,正确;②该反应的正反应为吸热反应,错误;③增大F的量,F是固体,浓度是定值,不会使得单位体积活化分子数增大,化学反应速率不变,错误;④恒温恒容条件下通入惰性气体,不改变各物质的浓度,平衡不移动,正确;⑤恒温恒压条件下通入惰性气体,各组分的浓度不变,化学反应速率不变,错误。

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的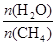 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: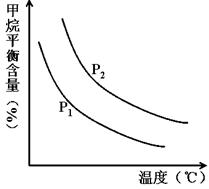
 N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( ) 2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是 2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol]:下列说法正确的是 B(g) + C(g);ΔH = ?48.25 kJ/L
B(g) + C(g);ΔH = ?48.25 kJ/L