题目内容
某温度下,已知反应mX(g)+nY(g)  qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
 qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是
qZ(g) ΔH<0,在一定体积的密闭容器中达到平衡,其他条件不变,下列叙述正确的是| A.若将容器体积变为原来一半,c(Z)为原来的1.8倍,则m+n<q |
| B.该反应达到平衡时,加入Y,该反应的ΔH改变增大 |
| C.升高温度,c(Y)/c(Z)的值减小 |
| D.使用催化剂,就可反应完全 |
A
试题分析:A、将容器体积变为原来一半的瞬间Z的浓度是原来的2倍,但最终平衡时c(Z)为原来的1.8倍,这说明增大压强平衡向逆反应方向移动,所以正方应是体积增大的,即m+n<q,A正确;B、反应热只与反应物与生成物总能量的相对大小有关系,与平衡移动无关,因此该反应达到平衡时,加入Y,该反应的ΔH不变,B不正确;C、正方应是放热反应,则升高温度平衡向逆反应方向移动,所以升高温度,c(Y)/c(Z)的值增大,C不正确;D、催化剂只能改变反应速率,而不能改变平衡状态,所以使用催化剂,反应液不可能反应完全,D不正确,答案选A。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下: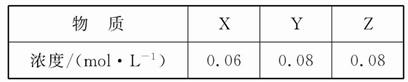
 Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入 nY(g) △H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) △H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示: C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度 CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
 N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是 2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )
2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )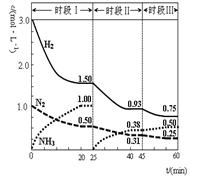
 N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )