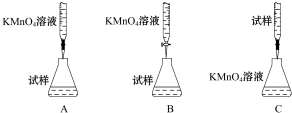
题目内容
14.在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g),采取下列措施能改变反应速率的是( )| A. | 增加Fe2O3的量 | B. | 增加Fe的量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
分析 对于反应Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g)来说,升高温度、增大浓度或压强、增大固体表面积可增大反应速率,以此解答该题.
解答 解:A.增加Fe2O3的量,反应物浓度不变,反应速率不变,故A不选;
B.铁为固体,增加固体的量,浓度不变,反应速率不变,故B不选;
C.充入N2,保持容器内压强不变,则体积增大,参加反应的气体的浓度减小,反应速率减小,故C选;
D.充入N2,保持容器内体积不变,体积不变,则浓度不变,反应速率不变,故D不选.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大,易错点为D,注意压强与浓度的关系.

练习册系列答案
相关题目
4.下列有机物的命名正确的是 ( )
| A. | 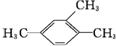 1,3,4-三甲苯 1,3,4-三甲苯 | B. | 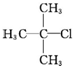 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | C. | 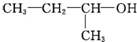 2-丁醇 2-丁醇 | D. | 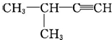 2-甲基-3-丁炔 2-甲基-3-丁炔 |
2.把NaHCO3和Na2CO3•10H2O混和物6.56g溶于水制成100mL溶液,其中c(Na+)=0.5mol/L.在该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质为2.925g.
9.下列说法不正确的是( )
| A. | 1mol固态物质或液态物质的体积主要决定于构成这种物质的粒子的大小 | |
| B. | 在相同温度和压强下,任何气体粒子之间的距离可看成相等的 | |
| C. | 某同学用容量瓶配制溶液加水时不慎超出刻度线必须重新配制 | |
| D. | 为与容量瓶的精度相匹配称量固体质量时应用托盘天平 |
19.用两个-X取代基和一个-Y取代基同时取代苯分子中3个氢原子,取代产物有( )
| A. | 4种 | B. | 6种 | C. | 10种 | D. | 14种 |
6.下列有关叙述不正确的是( )
| A. | 由于Al2O3熔点比Al高,所以在酒精灯上加热铝箔时,铝熔化但不滴落 | |
| B. | 铁丝不论在空气中还是纯氧中都不会燃烧 | |
| C. | 钠与氧气反应时,产物是由反应条件决定 | |
| D. | 金属单质与非金属单质发生反应时,被氧化的一定是金属单质 |