题目内容
9.下列各组物质不能实现直接转化的是( )| A. | SO2→H2SO4 | B. | Cu→CuCl2 | C. | Al2O3→Al(OH)3 | D. | Na→Na2O |
分析 A.二氧化硫和溴水、氯水等强氧化性物质反应生成硫酸;
B.铜和氯化铁反应生成氯化铜;
C.氧化铝和水不反应;
D.钠和氧气反应生成氧化钠.
解答 解:A.二氧化硫和溴水、氯水等强氧化性物质反应生成硫酸,所以能直接转化,故A不选;
B.铜和氯化铁反应生成氯化铜,所以能直接转化,故B不选;
C.氧化铝和水不反应,可以用氧化铝和稀盐酸反应制取氯化铝,然后用氨水和氯化铝反应制取氢氧化铝,故C选;
D.钠和氧气接触就反应生成氧化钠,不需要反应条件,所以能直接转化,故D不选;
故选C.
点评 本题考查元素化合物性质,为高频考点,涉及二氧化硫、Cu、氧化铝、钠的考查,易错是AB,注意二氧化硫不能直接和水反应制取硫酸、铜和稀盐酸不反应,为易错点.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
17.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
18.下列实验操作需要用温度计且不把它插入液体中的是( )
| A. | 乙醇制乙烯 | B. | 硝酸钾溶解度的测定 | ||
| C. | 实验室蒸馏石油 | D. | 煤的干馏 |
15.下列说法或表示方法中正确的是( )
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 已知中和热为57.3 kJ•mol-1,若将1L1mol•L-1醋酸与含1molNaOH溶液混合,放出的热量要小于57.3kJ | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
4.常温下,下列有关电解质溶液中相关微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
1.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,物质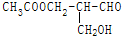 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
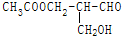 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在与Br2作用 |
18.CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O 的平衡体系中,加入H218O,一段时间后,则18O存在于( )
| A. | 只存在于乙酸分子中 | B. | 只存在于乙醇分子中 | ||
| C. | 只存在于乙醇、乙酸乙酯分子中 | D. | 只存在于乙酸、乙酸乙酯分子中 |
19.将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO${\;}_{4}^{2-}$完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
 .
.