题目内容
8.如图为某原电池装置的示意图.下列叙述中,正确的是( )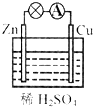
| A. | 负极发生的反应是Zn-2e-═Zn2+ | B. | 正极发生的是氧化反应 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后,铜片的质量增加 |
分析 A、原电池中锌做负极失电子生成锌离子;
B、装置图为原电池,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应;
C、溶液中氢离子在铜电极上得到电子生成氢气,溶液中氢离子浓度减小;
D、溶液中氢离子在铜电极上得到电子生成氢气,所以铜片的质量不变.
解答 解:A、原电池中锌做负极失电子生成锌离子,负极电极反应为:Zn-2e-=Zn2+,故A正确;
B、分析装置图可知,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应,故B错误;
C、溶液中氢离子在铜电极上得到电子生成氢气,2H++2e-=H2↑,溶液中氢离子浓度减小,溶液PH增大,故C错误;
D、溶液中氢离子在铜电极上得到电子生成氢气,2H++2e-=H2↑,所以铜片的质量不变,故D错误;
故选A.
点评 本题考查了原电池原理的分析判断,电极名称、电极反应和溶液PH变化等,原电池原理是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O 的平衡体系中,加入H218O,一段时间后,则18O存在于( )
| A. | 只存在于乙酸分子中 | B. | 只存在于乙醇分子中 | ||
| C. | 只存在于乙醇、乙酸乙酯分子中 | D. | 只存在于乙酸、乙酸乙酯分子中 |
19.将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO${\;}_{4}^{2-}$完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
16.下列气体中,溶于水后没有强酸生成的是( )
| A. | Cl2 | B. | SO2 | C. | SO3 | D. | NO2 |
3.下列关于乙醇的性质的说法中,不正确的是( )
| A. | 能与水以任意比互溶 | B. | 无色、无味的液体 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能与金属钠发生反应 |
13.下列有机物属于烃的是( )
| A. | C3H8 | B. | C2H5OH | C. | CH2Cl2 | D. | C6H5-NO2 |
20.常温下,下列盐溶液的pH>7的是( )
| A. | NaOH | B. | NaCl | C. | NH4Cl | D. | NaHC03 |
18.下列叙述中,正确的是( )
| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |
