题目内容
14.某元素的天然同位素有${\;}_{5}^{10}$X和${\;}_{5}^{11}$X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中${\;}_{5}^{10}$X和${\;}_{5}^{11}$X的原子个数之比为( )
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
分析 元素相对原子质量=各同位素相对原子质量与其物质的量含量的乘积之和.
解答 解:设10X物质的量为a,则11X的物质的量为b,则:10×$\frac{a}{a+b}$+11×$\frac{b}{a+b}$=10.8,整理可得a:b=1:4,即10X与11X的原子数目之比为1:4,故选:D.
点评 本题考查物质的量及相对分子质量的计算,利用十字相乘法计算更为简单,注意元素相对原子质量的计算,题目较简单.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
4.常温下,下列有关电解质溶液中相关微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
5.H3BO3是重要的难燃防火添加剂,H3BO3属于( )
| A. | 盐 | B. | 氧化物 | C. | 含氧酸 | D. | 混合物 |
9.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )


| A. | 1mol该有机物最多可以和5mol NaOH反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水或氢气反应,最多消耗3mol Br2或6molH2 |
19.将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,其中一份加入bmol的BaCl2,恰好使溶液中的SO${\;}_{4}^{2-}$完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为( )
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
6.下列关于金属腐蚀与防护的说法正确的是( )
| A. | 纯银器表面在干燥空气中因电化学腐蚀渐渐变暗 | |
| B. | 在海轮外壳连接锌块是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
3.下列关于乙醇的性质的说法中,不正确的是( )
| A. | 能与水以任意比互溶 | B. | 无色、无味的液体 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能与金属钠发生反应 |
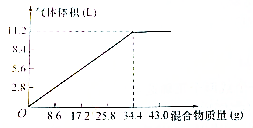 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固定混合物共热,若加入混合物的质量和产生气体的体积(已换算成标准装)的关系如图所示(假定生成的NH3全部逸出).试计算:
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4固定混合物共热,若加入混合物的质量和产生气体的体积(已换算成标准装)的关系如图所示(假定生成的NH3全部逸出).试计算: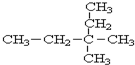 3,3-二甲基戊烷.
3,3-二甲基戊烷. .再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为
.再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是溶液呈紫色;向另一份溶液中加入浓溴水,反应的化学方程式为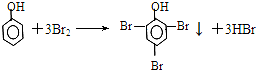 .从分液漏斗上口倒出的液体是苯.
.从分液漏斗上口倒出的液体是苯.