题目内容
3.下列关于溶液中的描述正确的是( )| A. | 常温时,NaNO2溶液的pH=8,则该溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:H++SO42++Ba2++OH-═BaSO4↓+H2O | |
| C. | 常温下物质的量浓度相等的下列四种溶液:①NH4HSO4;②CH3COONH4;③NH4Cl;④NH4Fe(SO4)2,四种溶液中c(NH4+)比较:②>①>④>③ | |
| D. | 常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液:Na+、K+、SiO32-、NO3-可以常量共存 |
分析 A.常温下pH=8的溶液中氢离子浓度为1×10-8mol•L-1,氢氧根离子浓度为1×10-6mol•L-1,然后结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(NO2-)进行计算;
B.溶液为中性时,硫酸氢钠与氢氧化钡按照物质的量2:1反应;
C.硫酸氢铵溶液中电离出的氢离子抑制了铵根离子的水解、醋酸根离子水解促进了铵根离子的水解、亚铁离子水解抑制了铵根离子水解,且硫酸亚铁铵中含有2个铵根离子,其铵根离子难度最大;
D.该溶液为酸性溶液,硅酸根离子与氢离子反应生成硅酸沉淀.
解答 解:A.常温下pH=8的溶液中氢离子浓度为1×10-8mol•L-1,氢氧根离子浓度为1×10-6mol•L-1,由电荷守恒可c(Na+)+c(H+)=c(OH-)+c(NO2-)可知:c(Na+)-c(NO2-)=c(OH-)-c(H+)=1×10-6mol/L-1×10-8mol/L=9.9×10-7mol•L-1,故A正确;
B.NaHSO4溶液与Ba(OH)2溶液反应至中性,氢离子与氢氧根离子的物质的量相等,正确的离子方程式为:2H++SO42++Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.常温下物质的量浓度相等的下列四种溶液:①NH4HSO4中氢离子抑制了铵根离子的水解;②CH3COONH4中醋酸根离子促进了铵根离子的水解;③NH4Cl正常水解;④NH4Fe(SO4)2中亚铁离子抑制了铵根离子水解,由于④的化学式中含有2个铵根离子,且铵根离子的水解程度进行,则④的铵根离子浓度最大,所以4种溶液中c(NH4+)大小为:④>①>③>②,故C错误;
D.常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液为酸性溶液,溶液中存在大量氢离子,SiO32-与氢离子反应生成硅酸,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高考常见题型和高频考点,题目难度中等,涉及盐的水解原理、离子共存、离子方程式书写、离子浓度大小比较等知识,侧重于学生的分析能力和计算能力的考查,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

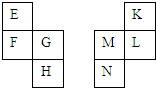 E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )
E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )| A. | 原子半径:M>L>K | |
| B. | F的单质与氧气反应只生成一种氧化物 | |
| C. | H与N的原子核外电子数相差14 | |
| D. | 最高价氧化物的水化物酸性:K>L>M |
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 将上面的塞子拿下,可以保证分液漏斗内的液体顺利流出 |
| A. |  如图表示改变某化学平衡体系的温度时,反应速率随时间的变化情况 | |
| B. |  如图表示向稀盐酸中滴加氢氧化钠溶液时,溶液pH的变化情况 | |
| C. | 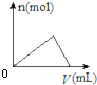 如图向氯化铝溶液中滴加氨水时,生成沉淀的物质的量变化情况 | |
| D. |  如图表示△H<0的可逆反应,化学平衡常数随温度的变化情况 |
| A. | NaCl | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
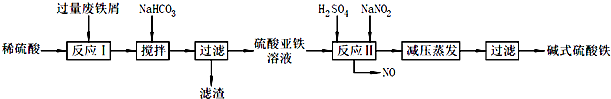
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
| A. | 加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀完全 | |
| B. | 该工艺中“搅拌”的作用是加快反应速率 | |
| C. | 在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol | |
| D. | 根据我国质量标准,产品中不得含有Fe2+,为了确定所得产品中是否含有Fe2+,所加试剂的顺序是先加KSCN溶液,后加氯水 |
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖能发生银镜反应 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖与蔗糖是同分异构体 |
| A. | 化合态的氟没有毒,含氟牙膏中的氟含量越多越好 | |
| B. | 火柴头中含有的氯元素为氯化钾 | |
| C. | 可用高锰酸钾来检测新装修居室内甲醛的浓度 | |
| D. | 火柴燃烧生成的气体不能使品红溶液褪色 |
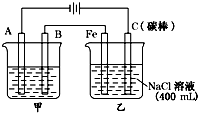 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答: