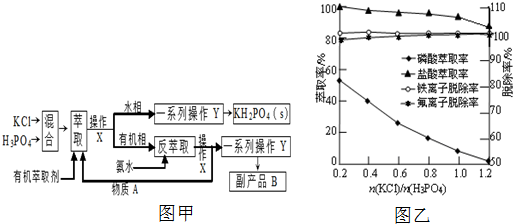
题目内容
13.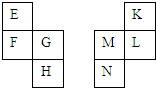 E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )
E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )| A. | 原子半径:M>L>K | |
| B. | F的单质与氧气反应只生成一种氧化物 | |
| C. | H与N的原子核外电子数相差14 | |
| D. | 最高价氧化物的水化物酸性:K>L>M |
分析 K的一种单质是空气中含量最多的物质,则K是N元素,则L是P元素、M是Si元素、N是Ge元素;E与K的原子序数相差4,H与N属同周期元素,则E是Li元素、F是Na元素、G是Mg元素、H是Ca元素.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
B.钠与氧气反应可以得到氧化钠、过氧化钠;
C.H是Ca元素、N是Ge元素,二者原子序数相差12;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:K的一种单质是空气中含量最多的物质,则K是N元素,则L是P元素、M是Si元素、N是Ge元素;E与K的原子序数相差4,H与N属同周期元素,则E是Li元素、F是Na元素、G是Mg元素、H是Ca元素.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:M>L>K,故A正确;
B.钠与氧气反应可以得到氧化钠、过氧化钠,故B错误;
C.H是Ca元素、N是Ge元素,二者原子序数相差12,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性K>L>M,所以最高价氧化物的水化物酸性强弱K>L>M,故D正确,
故选BC.
点评 本题考查位置结构性质的综合应用,注意对元素周期表与元素周期律掌握,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s内B的化学反应速率为( )
| A. | 0.04 mol/L | B. | 0.3 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 0.3 |
17.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )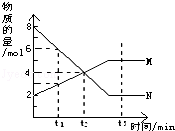

| A. | 反应的化学方程式为:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t1时,N的浓度是M的浓度的3倍 | D. | t3时,正反应速率大于逆反应速率 |
8.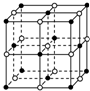 食盐晶体是由钠离子(图中的“
食盐晶体是由钠离子(图中的“ ”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
 食盐晶体是由钠离子(图中的“
食盐晶体是由钠离子(图中的“ ”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )| A. | 3.0×10-8 cm | B. | 3.5×10-8 cm | C. | 4.0×10-8 cm | D. | 5.0×10-8 cm |
18.符合实际并用于工业生产的是( )
| A. | Cl2通入澄清石灰水中制漂白粉 | B. | 用硫黄制硫酸 | ||
| C. | CO2通入氢氧化钠溶液中制Na2CO3 | D. | H2和Cl2光照制HCl |
5.在一定条件下,若要使反应CO(g)+NO2(g)?CO2(g)+NO(g)的反应速率增大可采取的措施有( )
| A. | 降低温度 | B. | 增大容器体积 | C. | 升高温度 | D. | 选用高效催化剂 |
2.下列反应中,不属于取代反应的是( )
| A. | 向苯酚中滴加浓溴水 | B. | 甲苯与浓硝酸、浓硫酸混合共热 | ||
| C. | 甲烷与氯气混合后见光 | D. | 乙醇与浓硫酸混合加热至170℃ |
3.下列关于溶液中的描述正确的是( )
| A. | 常温时,NaNO2溶液的pH=8,则该溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:H++SO42++Ba2++OH-═BaSO4↓+H2O | |
| C. | 常温下物质的量浓度相等的下列四种溶液:①NH4HSO4;②CH3COONH4;③NH4Cl;④NH4Fe(SO4)2,四种溶液中c(NH4+)比较:②>①>④>③ | |
| D. | 常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液:Na+、K+、SiO32-、NO3-可以常量共存 |